|
Évolution forcée d’un système chimique |
|
|
|
|
|
|
QCM N° 08
Évolution forcée
d’un système chimique
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
On introduit
initialement
n1
= 3,0 × 10–2 mol
d’ions fer III,
Fe3+ (aq)
et n2
= 2,0 × 10–2 mol
de zinc
métallique
Zn
(s), qui réagissent
selon la réaction
d’équation : 2
Fe3+ (aq) + 3 Zn (s) → 2
Fe (s) + 3 Zn2+ (aq)
Pour un
avancement x,
les quantités de
matières sont : |
3 n1
– x
pour
Zn
(s)
Et
3 n1
pour
Zn2+
(aq) |
n1
– 2x
pour
Fe3+
(aq)
Et
2x
pour
Fe
(s) |
n1
– 3x
pour
Zn
(s)
Et
3 n1
pour
Zn2+
(aq) |
B |
|
2 |
On introduit
initialement
n1
= 3,0 × 10–2 mol
d’ions fer III,
Fe3+ (aq)
et n2
= 2,0 × 10–2 mol
de zinc
métallique
Zn
(s), qui réagissent
selon la réaction
d’équation : 2
Fe3+ (aq) + 3 Zn (s) → 2
Fe (s) + 3 Zn2+ (aq)
Il se forme 2,0 ×
10–2 mol
d’ions zinc II.
À l’état final : |
Tous les
réactifs
ont
disparu |
La
transformation
est totale |
La
transformation
est non totale |
B |
|
3 |
Pour une
transformation
non totale en fin
de
réaction |
Tous les
réactifs sont
présents et
un produit
est limitant |
Tous les
réactifs et
produits
sont présents |
Tous les
produits
sont présents
et un
réactif est
limitant |
B |
|
4 |
Le quotient de
réaction
Qr
de la réaction
d’équation : 2
Fe3+ (aq) + 3 Zn (s) → 2
Fe (s) + 3 Zn2+ (aq)
s’exprime par : |
|
|
|
C |
|
5 |
Quand un système
évolue
de façon
spontanée : |
Qr
tend
vers K
|
Qr
tend
vers 0 |
Qr
tend
vers l’infini |
A |
|
6 |
L’équation de la
réaction
entre les ions
fer II et les
ions permanganate
est :
5 Fe2+ + MnO4–
+ 8
H+
→
5 Fe3+ + Mn2++
4 H2O Les ions fer II,
Fe2+ : |
est oxydé
par les
ions
hydrogène |
gagne un
électron pour
former Fe3+ |
cède un
électron pour
former Fe3+ |
C |
|
7 |
L’équation de la
réaction entre les ions
fer II et les ions
permanganate est :
5
Fe2+ + MnO4–
+ 8 H+
→
5
Fe3+ + Mn2++
4 H2O Les ions fer II,
Fe2+ : |
Oxyde
l’ion
MnO4– |
est un
oxydant |
est un
réducteur |
C |
|
8 |
L’équation de la
réaction entre les ions
fer II et les ions
permanganate est :
5
Fe2+ + MnO4–
+ 8 H+
→
5
Fe3+ + Mn2++
4 H2O Les ions MnO4–: |
Subit une
oxydation |
Subit une
réduction |
Est un
réducteur |
B |
|
9 |
À la borne
négative d’une pile, il y
a : |
Un gain
d’électrons |
Une
réduction |
Une oxydation |
C |
|
10 |
Dans le pont
salin reliant les deux
demi-piles, les
cations migrent : |
Vers la
borne
positive |
Vers la
borne
négative |
Dans le
sens des
électrons |
A |
|
11 |
On considère une
pile Fer-aluminium
dont l’équation de
fonctionnement
est : 3
Fe2+ (aq) + 2 Aℓ (s) → 3
Fe (s) + 2 Aℓ3+ (aq) Pour 0,30 mol de
fer
Fe
(s) formé |
0,30 mol
d’électrons
sont
échangés |
0,90 mol
d’électrons
sont
échangés |
0,60 mol
d’électrons
sont
échangés |
C |
|
12 |
Une pile produit
un courant
d’intensité I pendant une
durée Δt. L’équation de la
réaction chimique est
équilibrée avec le
transfert de z électrons. La
capacité de la pile est
égale à : |
|
Q
= I × Δt |
Q
= z × I × Δt |
B |
|
13 |
Une pile permet
l’échange d’une quantité
d’électricité Q
jusqu’à son usure complète.
L’équation de la réaction est
équilibrée avec un transfert de z électrons. L’avancement
final vaut xf et ion note F la constante de Faraday : |
|
F
est
exprimé en C
. mol–1 |
|
B |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
Réaction chimique : Tableau d’avancement, bilan de
matière
-
Quantité de matière d’ions
fer III
-
n1
= 3,0 × 10–2 mol = 30
mmol
-
Quantité de matière de zinc
métallique :
-
n2
= 2,0 × 10–2 mol = 20
mmol
-
Équation bilan de la réaction
|
2 Fe3+ (aq)
|
+ 3 Zn (s) |
→ |
2
Fe (s) |
+ 3 Zn2+ (aq) |
-
Attention : réponse
n1
– 2 x
et 2 x
-
Tableau d’avancement de la
réaction :
|
Équation |
2 Fe3+ (aq)
|
+ 3 Zn (s) |
→ |
2
Fe (s) |
+ 3 Zn2+ (aq) |
|
|
État du
système |
Avancement |
n (Fe3+)
|
n (Zn) |
|
n (Fe) |
n
(Zn2+) |
|
État initial
(mmol) |
x =
0 |
n1
= 30 |
n2
= 20 |
0 |
0 |
|
|
État
intermédiaire |
0 ≤ x ≤ xf |
n1
– 2 x
30 – 2 x |
n2
– 3 x
0,40 –
3 x |
2 x |
3 x |
|
|
État final
(mmol) |
x = xf |
30 – 2 xf |
0,40 –
3 xf |
|
2 xf |
3 xf |
|
État maximal
(mmol) |
x = xmax |
0,10 – 2 xmax |
0,40 –
3 xmax |
|
2 xmax |
3 xmax |
-
Relations :
n1
– 2 x
pour Fe3+
(aq) et 2 x
pour Fe
(s)
Transformation totale :
-
L’équation s’écrit avec
-
une double flèche
![]() si
la réaction est non totale ;
si
la réaction est non totale ;
-
une simple flèche → si la
réaction est totale.
-
Comme l’indique la flèche, la
transformation est totale (→)
-
Lorsqu’une réaction est
totale, l’avancement final est égal à l’avancement maximal :
-
xf
= xmax
-
Tableau
d’avancement et bilan de matière.
|
Équation |
2 Fe3+ (aq)
|
+ 3 Zn (s) |
→ |
2
Fe (s) |
+ 3 Zn2+ (aq) |
|
|
État du
système |
Avancement |
n (Fe3+)
|
n (Zn) |
|
n (Fe) |
n
(Zn2+) |
|
État initial
(mmol) |
x =
0 |
n1
= 30 |
n2
= 20 |
0 |
0 |
|
|
État
intermédiaire |
0 ≤ x ≤ xf |
n1
– 2 x
30 – 2 x |
n2
– 3 x
20 –
3 x |
2 x |
3 x |
|
|
État final
(mmol) |
x = xf ≈ 6,7 |
30 – 2 xf
≈ 16,7
≈ 17 |
20 – 20 = 0 |
|
2 xf |
3 xf
= 20 |
|
État maximal
(mmol) |
xmax = xf |
|
|
|
|
|
-
Exploitation :
-
Valeur de l’avancement
maximal :
-
Hypothèse 1 : On considère que l’ion
Fe3+ (aq)
est le réactif limitant :
-
Dans ce cas :
n1 –
2 xmax1
= 0 =>
n1 =
2 xmax
= 3,0 × 10–2 mol
-
xmax1
≈ 1,5 × 10–2 mol
-
Hypothèse 2 :
On considère que
Zn (s)
est le réactif limitant
-
Dans ce cas :
n2
– 3 xmax2
= 0 =>
n2 =
3 xmax2
= 2,0 × 10–2 mol
-
xmax2
≈ 6,7 × 10–3 mol
-
Conclusion :
-
L’avancement maximal est égal à la plus
petite des deux valeurs :
-
xmax =
xmax2
≈ 6,7 × 10–3 mol <
xmax1
-
D’autre part :
-
On donne
n (Zn2+
) = 2,0 × 10–2 mol
-
On en déduit la valeur de
l’avancement final :
-
n
(Zn2+
) =
3 xf
= 2,0 × 10–2 mol =>
xf
≈ 6,7 × 10–3 mol
-
Comme
n (Zn)
= 0,
-
Zn
(s) est le réactif limitant (il est totalement consommé :
n2
– 3 xf
= 0
-
Comme :
-
xf =
xmax, la transformation est totale.
Transformation non totale. Équilibre chimique
Chap N° 07 Sens d’évolution
spontanée d’un système chimique
-
Lorsqu’une réaction est
totale, l’avancement final est égal à l’avancement maximal :
-
xf
= xmax
-
En présence d’un équilibre chimique (cas
d’une réaction non totale) :
-
xf
< xmax
-
Comparer
l’avancement final xf
et l’avancement maximal xmax
permet de distinguer les transformations totales et non totales.
-
Pour une
transformation non totale, il faut connaître la valeur de l’avancement final
xf
pour effectuer le bilan de matière à l’état final.
-
Dans le cas d’une
transformation non totale :
-
À l’état final :
-
Les quantités des espèces ne
varient plus ;
-
Tous les réactifs et les
produits coexistent.
-
On est en
présence d’un équilibre chimique.
-
Lors d’une réaction non
totale :
-
Les
réactifs
réagissent entre eux pour donner les
produits ;
-
Simultanément :
-
Les
produits
réagissent pour donner les
réactifs.
-
Une réaction non totale est
modélisée par deux réactions opposées l’une de l’autre.
-
L’équation de la réaction
s’écrit alors avec une double flèche
![]() qui
traduit le fait que deux réactions, inverses l’une de l’autre, peuvent se
produire simultanément dans le système.
qui
traduit le fait que deux réactions, inverses l’une de l’autre, peuvent se
produire simultanément dans le système.
-
L’équation s’écrit alors :
a A
+ b B
![]() c
C + d
D
c
C + d
D
-
Exemple :
-
xf = 0,85 mol et
xmax = 1,0 mol
|
Équation |
N2
(g) + |
3 H2
(g) |
|
2
NH3 (g) |
|
|
état |
Avanc.
x
(mol) |
n (N2)
(mol) |
n (H2)
(mol) |
|
n (NH3)
(mol) |
|
État initial |
x |
2 |
3 |
|
0 |
|
Au cours de la
transformation |
x |
2 –
x |
3– 3
x |
2 x |
|
|
État final |
xf |
2 –
xf
|
3 –
3 xf
|
|
2 xf |
|
À l’équilibre |
xf = 0,85 |
1,15 |
0,45 |
|
1,7 |
-
Tous les réactifs et produits
sont présents à l’état final.
Le quotient de réaction :
-
Considérons la réaction
chimique non totale suivante :
a
. A
(aq) +
b
. B
(aq)
![]() c
. C
(aq) +
d
.
D
(aq)
c
. C
(aq) +
d
.
D
(aq)
-
Par
définition, le quotient de réaction
Qr
de cette réaction s’écrit :
|
|
|
|
Qr |
Quotient de
réaction (sans unité) |
|
[C]
et
[D] |
Concentration des
produits (mol . L–1) |
|
[A]
et
[B] |
Concentration des
réactifs (mol . L–1) |
|
C0 |
Concentration
standard : C0 =
1,0 mol . L–1 |
►
Remarque :
-
Pour
simplifier l’expression, on omet de mettre la concentration standard
C0.

-
Mais, il ne
faut pas oublier que le
quotient de réaction est une grandeur
sans unité
qui caractérise un système chimique dans un état donné.
-
Cas d’une réaction où le
solvant intervient :
-
Par
convention, l’eau, solvant, n’intervient pas dans
l’écriture de l’expression de
Qr
(même s’il intervient dans l’équation de la réaction.
►
Exemple : réaction entre l’acide
éthanoïque et l’eau :
|
CH3COOH
(aq) |
+ |
H2O
(ℓ) |
|
CH3COO– (aq) |
+ |
H3O+ (aq) |
-
Dans cette réaction, l’eau est le
solvant.
-

- Cas d’une réaction avec des espèces solides :
-
Les espèces chimiques solides
n’apparaissent pas dans l’expression du quotient de réaction.
►
Exemple : écrire le
quotient de réaction de la réaction suivante :
|
Cu (s) |
+ |
2 Ag+
(aq) |
|
Cu2+
(aq) |
+ |
2 Ag (s) |
-

-
Pour la réaction :
|
2 Fe3+ (aq) |
+ |
2 Zn
(s) |
|
2 Fe
(s) |
+ |
3 Zn2+ (aq) |
-

Constante d’équilibre K.
-
Dans l’état
d’équilibre d’un système, le quotient de réaction
Qr,éq
prend une valeur qui ne dépend pas de l’état initial.
-
La valeur de
Qr,éq
est indépendante de la composition initiale.
-
Cette valeur ne dépend que de
la température.
-
Elle est
appelée constante d’équilibre et on la note
K.
K = Qr,éq
-
La valeur de la constante
d’équilibre nous renseigne sur la nature de la réaction chimique.
►
Système chimique hors
d’équilibre :
-
Tout système chimique, hors
d’équilibre, évolue spontanément vers un état d’équilibre.
-
En conséquence la valeur de
Qr
tend vers K
-
À une
température donnée, la comparaison du quotient de réaction dans l’état initial,
Qr,i
à la constante d’équilibre
K
permet de prévoir le sens d’évolution spontanée du système chimique.
►
Premier cas :
-
Si le quotient
de réaction initial Qr,i
est égal à la constante d’équilibre
K,
-
Soit
Qr,i
= K,
le système est déjà à l’équilibre.
-
Il n’évolue pas.
►
Deuxième cas :
-
Si le
quotient de réaction initial
Qr,i
est inférieur à la constante d’équilibre
K,
-
soit
Qr,i
< K,
-
Le système chimique
évolue spontanément vers un état d’équilibre.
-
Il évolue dans le
sens direct
de l’écriture de l’équation de la réaction.
►
Troisième cas :
-
Si le
quotient de réaction initial
Qr,i
est supérieur à la constante d’équilibre
K,
-
soit
Qr,i
> K,
le système chimique évolue spontanément vers un état d’équilibre.
-
Il évolue dans le
sens inverse
de l’écriture de l’équation de la réaction.

►
Remarque :
-
Ce critère d’évolution
permet de prévoir le sens d’évolution spontanée du système connaissant sa
composition initiale.
-
Ce critère ne tient
pas compte de l’aspect cinétique de la réaction.
Réaction d’oxydoréduction :
-
Un oxydant est une entité
chimique capable de gagner un ou plusieurs électrons.
-
(Oxydant :
gagne)
-
Un réducteur est une entité
chimique capable de perdre un ou plusieurs électrons.
-
(Réducteur :
perd)
-
Couple oxydant / réducteur :
-
À tout couple oxydant /
réducteur, on associe la demi-équation électronique d’oxydoréduction suivante :
|
Ox |
+ |
n
e – |
|
Red |
-
Ceci est une écriture
formelle.
-
La double flèche traduit la
possibilité de passer d’une forme à l’autre suivant les conditions
expérimentales.
-
La
transformation chimique qui correspond au passage de l’oxydant
Ox
à son réducteur conjugué
Red est une réduction :
Ox + n
e
– →
Red
-
Une réduction est un gain
d’électrons.
-
La
transformation chimique qui correspond au passage du réducteur
Red
à son oxydant conjugué
Ox est une oxydation :
Red →
Ox + n
e –
-
Une oxydation est une perte
d’électrons.
-
Au cours d’une réaction
d’oxydoréduction, un oxydant est réduit et un réducteur est oxydé.
-
Une réaction d’oxydoréduction
est une réaction de transfert d’électrons.
-
Elle fait
intervenir deux couples Ox /
Red : Ox1
/ Red1 et
Ox2 /
Red2
-
Ox1
ne peut pas réagir sur
Ox2 et
Red1
ne peut pas réagir sur
Red2
-
Ox1
peut réagir sur Red2
ou Ox2
peut réagir sur Red1
-
Cela dépend de la force
relative des oxydants et des réducteurs mis en présence.
-
Au cours d’une réaction
d’oxydoréduction :
-
Un oxydant est réduit et
-
Un réducteur est oxydé.
-
Fe2+
→ Fe3+
+ e– :
couple Ox / Red :
Fe3+
/ Fe2+
-
Au cour de la réaction
suivante :
5
Fe2+
+ MnO4–
+ 8 H+
→ 5
Fe3+
+ Mn2++
4 H2O
-
L’ion
Fe2+
cède un électron pour former Fe3+
-
L’ion
Fe2+
est un réducteur, il subit une oxydation
-
L’ion
MnO4–
est un oxydant, il subit une réduction
Couples oxydant / réducteur :
-
Couples
Ox / Red :
Fe3+
/ Fe2+ :
MnO4–
/ Mn2+
-
Le couple
MnO4
–
/ Mn2+.
|
|
Demi-équation électronique |
|
Première étape :
On écrit le couple
oxydant / réducteur |
MnO4–
|
|
Deuxième
étape :
On équilibre
l’élément oxygène
avec de l’eau |
MnO4–
|
|
Troisième
étape :
On équilibre
l’élément hydrogène
avec
H+
(on travaille en milieu acide) |
MnO4–
+
8
H+ |
|
Quatrième
étape :
On équilibre
les charges avec
les électrons. |
MnO4–
+
8
H+
+ 5
e
–
|
-
Conclusion : l’ion
permanganate est un oxydant en milieu acide.
Oxydation et réduction :
-
Un oxydant est réduit, il
subit une réduction
-
Un réducteur est oxydé, il
subit une oxydation.
-
L’ion
permanganate MnO4– est un oxydant, il subit une
réduction.
-
MnO4–
+
8
H+
+ 5
e
–
→ Mn2+
+
4
H2O.
-
Ox + n e–
→ Red
Les piles :
-
Constitution d’une pile.

-
Deux
compartiments distincts contenant chacun un couple
OX / RED
du type Mn+
(aq) / M
(s) et reliés par un pont électrochimique (ou pont salin) constituent un
générateur électrochimique appelé pile.
-
L’ensemble
constitué par une plaque de métal
M plongeant dans une solution contenant
des cations Mn+
constitue une demi-pile.
-
La plaque de métal est
appelée aussi électrode.
-
Les transferts d’électrons se
produisent à la surface de l’électrode.
-
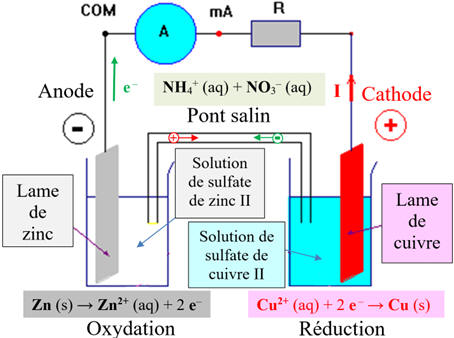
Le pôle
–
de la pile est le siège d'une
oxydation,
on l'appelle
l'anode.
-
Le pôle
+
de la pile est le siège d'une
réduction,
on l'appelle la
cathode.
-
Le courant généré par cette
pile circule de la cathode (électrode positive) vers l’anode (électrode
négative) à l’extérieur de la pile.
-
Les électrons, responsables
du passage de ce courant dans le circuit électrique (fils et électrodes),
circule de l’électrode de l’anode (électrode négative) vers la cathode
(électrode positive) à l’extérieur du circuit.
-
À l’intérieur de la pile les
porteurs de charges sont les ions.
-
Le courant électrique à
l’intérieur de la pile est dû à la double migration des ions positifs et
négatifs, présents dans les différentes solutions, se déplaçant en sens
inverses.
-
Les cations se déplacent dans
le sens du courant électrique et les anions se déplacent en sens inverse de
celui du courant électrique.
-
Le pont salin : il assure la
jonction électrique entre les solutions contenues dans les deux béchers.
-
Dans le pont salin,
-
Les cations se déplacent dans
le sens du courant électrique : Ils viennent compenser la disparition des ions
M2n+.
-
Les anions se déplacent en
sens inverse de celui du courant électrique : Ils viennent compenser
l’apparition des ions M1n+.
-
Exemple de pile : La pile
Daniell.
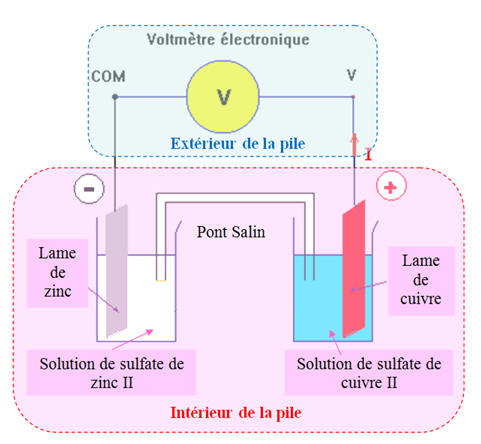
-
Polarité de la pile,
réactions aux électrodes et nom des électrodes.
-
À la borne positive, ici
l’électrode de cuivre, les électrons qui arrivent sont consommés par la réaction
Cu2+
(aq)
+
2
e
–
→ Cu (s)
-
Cette électrode est appelée
la Cathode.
-
À la borne négative de la
pile, ici l’électrode de zinc les électrons sont créés par la réaction
Zn (s)
→
Zn2+
(aq)
+
2
e
–
-
Cette électrode est appelée
l’anode.
-
Les termes anode et cathode
pour noter les électrodes d’une pile ou d’un générateur.
-
L’anode
désigne toujours l’électrode où se produit l’oxydation.
-
La
cathode désigne toujours l’électrode où se
produit la réduction.
|
Réduction |
|
|
|
Ox
+
n
e
–
|
|
|
|
Oxydation |
-
La
transformation chimique qui correspond au passage de l’oxydant
Ox
à son réducteur conjugué
Red est une réduction. :
-
Une réduction est un gain
d’électrons.
-
La
transformation chimique qui correspond au passage du réducteur
Red
à son oxydant conjugué
Ox est une oxydation :
-
Une oxydation est une perte
d’électrons.
-
Au cours d’une réaction
d’oxydoréduction, un oxydant est réduit et un réducteur est oxydé
Le pont salin :

-
Rôle du pont salin :
-
La
solution gélifiée de nitrate d’ammonium (NH4+
(aq) + NO3–
(aq)), présente dans le pont salin, assure la jonction électrique entre les
solutions contenues dans les deux béchers.
-
Les cations se déplacent dans
le sens du courant électrique et les anions se déplacent en sens inverse de
celui du courant électrique.
Quantité de matière d’électrons échangés :
-
Pour connaître la quantité de
matière d’électrons échangés, il faut utiliser le tableau d’avancement et les
demi-équations électroniques.
-
Tableau d’avancement :
|
Équation |
3 Fe2+ (aq)
|
+
2 Al (s) |
|
3
Fe (s) |
+
2 Al3+ (aq) |
|
|
État du
système |
Avancement |
n (Fe2+)
|
n (Al) |
|
n (Fe) |
n
(Al3+) |
|
État initial
(mmol) |
x =
0 |
n1
|
n2
|
0 |
0 |
|
|
État
intermédiaire |
0 ≤ x ≤ xf |
n1
– 3 x |
n2
– 2 x |
3 x |
2 x |
|
|
État final
(mmol) |
x = xf ≈ 6,7 |
n1
– 3 xf |
n2
– 2 xf |
|
3 xf |
2 xf |
|
Donnée : |
|
|
|
|
0,30 mol |
|
-
Demi-équation électronique :
-
On considère la demi-équation
électronique faisant intervenir l’élément fer :
|
Fe2+ (aq)
|
+
2 e– |
→ |
Fe
(s) |
|
|
Équation |
Fe3+ (aq) |
+
2
e– |
→ |
Fe
(s) |
|
|
état |
Avancement
x
(mol) |
mol |
mol |
|
mol |
|
État initial (mol) |
0 |
n1
|
0 |
|
0 |
|
Au bout
de la durée
Δt |
x |
n1
– x |
2 x |
x |
|
-
Du tableau d’avancement, on
tire :
-
n
(e
– ) = 2
x
= 0,60 mol
Quantité d’électricité :
-
L’intensité I
du courant produit par la pile pendant la durée
Δt
est donnée par la relation suivante :
|
|
|
|
I |
Intensité du
courant (A) |
|
Q |
Quantité
d’électricité mise en jeu (C) |
|
Δt |
Durée de
fonctionnement de la pile (s) |
-
La quantité
d’électricité Q mise en jeu au cours du
fonctionne de la pile pendant la durée
Δt :
|
Q
= n (e–) . F |
|
|
Q |
Quantité
d’électricité mise en jeu (C) |
|
n
(e–) |
Quantité de
matière d’électrons échangés (mol) |
|
F |
Constante de
Faraday : F = 96500 C . mol–1 |
-
Constante de Faraday :
-
La valeur absolue de la
charge d’une mole d’électrons définit le faraday de symbole
F.
-
1
F
= |NA
. n (e–)|
Quantité d’électricité :
-
La quantité d’électricité
mise en jeu au cours du fonctionnement d’une pile est égale à la valeur absolue
de la charge totale des électrons échangés.
-
On écrit :
-
Q
= n (e–)
. F
-
La valeur absolue de la
charge d’une mole d’électrons définit le faraday de symbole
F.
-
1
F = |NA
. (–e)|
≈ 96500 C . mol–1
-
Nombre d’Avogadro :
NA
= 6,02 × 1023 mol–1
|
|