|
Transformation nucléaire. Cours. |
|
|
|
|
|
|
II- La transformation
nucléaire. |
|
|
|
a)- Exercice 5
page 138 : Reconnaitre des isotopes. b)- Exercice 9
page 138 : Identifier une particule. c)- Exercice 11
page 139 : Utiliser les lois de conservation d)- Exercice 12
page 139 : Écrire une réaction nucléaire. e)- Exercice 13
page 139 : Écrire une équation de réaction nucléaire. f)- Exercice 14
page 139 : Utiliser une équation de réaction. g)- Exercice 19
page 140 : Formation d’éléments chimiques. h)- Exercice 22
page 141 : Datation au carbone 14. |
|
Transformations nucléaires |
-
Un élément chimique est caractérisé par son numéro atomique
Z.
-
Tous les représentants, atomes ou ions, d’un élément chimique
donné ont :
-
Des noyaux contenant le même nombre de protons ;
-
Le même symbole chimique
X.
-
Rappel : le noyau, d’un atome ou d’un ion de symbole chimique
X,
-
Comporte :
-
Z protons et
A nucléons (et
A –
Z
neutrons).
-
On le note :
![]()
![]() Définition :
Définition :
-
Des atomes ou des ions isotopes possèdent le même nombre de
protons Z et un nombre de neutrons
N différent.
-
Ils ont le même numéro atomique
Z, mais un nombre de
nucléons A différent (A =
Z +
N)
-
Les atomes isotopes portent le même nom que l’élément chimique
auquel ils appartiennent, suivi de leur nombre de nucléons
A.
-
Exemple :
-
On considère les nucléides (Z, A) suivants : (6,12),
(6,13), (6,14).
-
On remarque que
Z = 6.
-
Cette valeur de
Z caractérise l’élément carbone de symbole
C.
-
pour les nommer, on
ajoute à leur nom le nombre de nucléons de leur noyau :
-
On parle de carbone 12, de carbone 13 et de carbone 14.
|
Atomes isotopes |
|||||||
|
12
6 |
C |
|
13
6 |
C |
|
14
6 |
C |
|
98,9 % |
1,1 % |
Traces |
|||||
|
Composition d'un morceau de graphite |
|||||||
-
Les propriétés chimiques d’un atome sont liées à la structure de
son cortège électronique.
-
En conséquence, les atomes isotopes ont la même réactivité
chimique car leurs cortèges électroniques sont identiques.
II-
La transformation
nucléaire.
-
Lors d’une transformation nucléaire :
-
Un ou plusieurs noyaux réactifs se transforment en de nouveaux
noyaux ;
-
Les éléments chimiques ne sont pas conservés ;
-
Un rayonnement, dit « gamma » (γ) est émis.
-
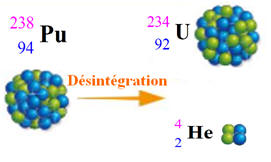
Exemple :
-
Le noyau d’un atome de plutonium 238, d’écriture conventionnelle,![]()
-
Se scinde en deux noyaux :
-
Un noyau d’uranium 234, ![]()
-
Et un noyau d’hélium ![]()
-
Visualisation de la réaction :
2)- Équation de réaction nucléaire.
-
Une transformation nucléaire est modélisée par une réaction dans
laquelle interviennent :
-
Les particules qui réagissent,
-
Et les particules formées.
-
Particule : une particule est caractérisée par son nombre de masse
A et son nombre de charge
Z.
-
Elle est symbolisée par l’écriture conventionnelle :
![]() ou
ou
![]()
-
Symboles de quelques particules :
|
Nom |
Électron |
Positon |
Neutron |
Proton |
Noyau d’Hélium |
|
Symbole |
|
|
|
|
|
|
Nom de
la particule |
Particule
β– |
Particule
β+ |
|
|
Particule
α |
-
Exemple 1 :
-
La désintégration d’un noyau de carbone 14 donne un noyau d’azote
14 et l’émission d’un électron.
|
14
6 |
C |
→ |
14
7 |
N |
+ |
0
– 1 |
e |
|
Carbone |
Azote |
Particule
β
– |
|||||
-
Équation d’une réaction nucléaire :
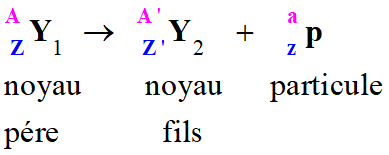
-
Au cours de cette réaction nucléaire, il y a conservation :
-
Du nombre de masse :
A =
A’ +
a
-
Du nombre de charge :
Z =
Z’ + z
-
Les lois de conservation qui régissent l’écriture des équations
nucléaires sont appelées :
-
Lois de
SODDY.
-
Lors d’une transformation nucléaire, une partie de l’énergie
nucléaire contenue dans les noyaux réactifs est transformée en énergie
rayonnante.
-
Exemple :
-
Dans le Soleil ou dans les réacteurs des centrales nucléaires, les
transformations nucléaires libèrent de grandes quantités d’énergie.
-
Ainsi, chaque seconde, le Soleil libère une énergie égale à 3,9
×
1026 J.
Masse et énergie : réactions nucléaires

III-
L’identification de
la nature d’une transformation.
-
Pour identifier la nature de la transformation, une analyse des
réactifs et des produits est nécessaire.
-
Réactifs
et
produits correspondent à des espèces
chimiques identiques dont seuls les états physiques différent.
-
Exemple : passage de l’eau de l’état liquide à l’état gazeux :
Vaporisation
-
La vaporisation de l’eau peut être modélisée par l’équation
suivante :
H2O
(ℓ) →
H2O
(g)
-
Réactifs et
produits correspondent à des espèces
chimiques différentes, mais avec conservation des éléments chimiques et de la
charge électrique.
-
Exemple :
Réaction entre le méthane et le dioxygène.
|
|
Réactifs |
|
Produits |
|
Équation
chimique |
CH4
(g) + 2
O2 (g) |
→ |
CO2
(g) + 2
H2O (g) |
4)- Transformation nucléaire :
-
Réactifs et
produits correspondent à des éléments
chimiques différents
-
Exemple :
|
|
Réactif |
|
Produits |
|
Équation
nucléaire |
|
→ |
|
a)- Les différents isotopes de l’iode.
-
L’iode possède 37 isotopes connus, de nombre de masse compris
entre 108 et 144.
-
Les isotopes notables : iode 123, l’iode 124, l’iode 127 et l’iode
131.
b)- L’iode 123 :
-
![]() : le
noyau est constitué de 53 protons et 70 neutrons.
: le
noyau est constitué de 53 protons et 70 neutrons.
-
Il est radioactif et est utilisé pour la scintigraphie.
-
L’iode 123, radioactif, émet un rayonnement, qui une fois mesuré,
permet d’obtenir un cliché de la thyroïde.
-
L’iode 123 se désintègre par capture électronique. Il y a émission
« gamma » γ de 159 keV.
-
Équation de désintégration :
![]() +
+
![]() →
→
![]() + γ
+ γ
c)- L’iode 124 :
-
![]() : le
noyau est constitué de 53 protons et 71 neutrons.
: le
noyau est constitué de 53 protons et 71 neutrons.
-
Il est radioactif.
d)- L’iode 127 :
-
![]() : le noyau est constitué de 53 protons et 74 neutrons.
: le noyau est constitué de 53 protons et 74 neutrons.
-
C’est le seul isotope stable de l’iode. Il est présent dans la
nature.

-
Il fait partie des
halogènes (famille des halogènes).
-
Il est indispensable à la glande thyroïde pour
produire des hormones thyroïdiennes qui contribuent au bon développement du
cerveau, à la régulation de la température du corps, …
-
Les apports quotidiens recommandés en iode 127
sont de l’ordre de 150 microgrammes.
-
En cas de fuite d’iode 131, dans une centrale
nucléaire, l’Autorité de sûreté nucléaire recommande la prise de comprimés
d’iodure de potassium qui contiennent de l’iode 127, non radioactif pour saturer
la thyroïde en iode.

-
Ainsi, l’iode 131, potentiellement cancérigène
n’est plus fixé par la thyroïde.
e)- L’iode 131 :
-
![]() :
le noyau est constitué de 53 protons et 78 neutrons.
:
le noyau est constitué de 53 protons et 78 neutrons.
-
L’iode 131 est émetteur (β–,
γ). Les
photons émis ont une énergie de 364 keV.
-
Équation de désintégration :
![]() →
→
![]() +
+
![]() +
γ
+
γ
-
L’iode 131 est un produit très toxique. Il est
potentiellement cancérigène.
-
Il constitue un risque important de contamination
de l’environnement lors de catastrophe nucléaire (Tchernobyl). Il se concentre
sur la thyroïde.
-
C’est un des produits de fission des réacteurs
nucléaires.
-
L’iode 131 sert en médecine à l’étude du
fonctionnement de la thyroïde, at aussi au traitement des hyperthyroïdies et des
cancers de la thyroïde.
-
À faible dose, l’iode 131 est utilisé comme
traceur pour les diagnostics en médecine nucléaire.
-
À forte dose, l’iode 131 est utilisé pour la
radiothérapie des cancers de la thyroïde.
|
Transformations nucléaires |
|
a)- Exercice 5
page 138 : Reconnaitre des isotopes. b)- Exercice 9
page 138 : Identifier une particule. c)- Exercice 11
page 139 : Utiliser les lois de conservation d)- Exercice 12
page 139 : Écrire une réaction nucléaire. e)- Exercice 13
page 139 : Écrire une équation de réaction nucléaire. f)- Exercice 14
page 139 : Utiliser une équation de réaction. g)- Exercice 19
page 140 : Formation d’éléments chimiques. h)- Exercice 22
page 141 : Datation au carbone 14. |