|
Synthèse de l'acide benzoïque. Correction
|
|
|
|
|
|
I-
Synthèse d’un acide carboxylique : L’acide benzoïque.
(Séance de travaux pratiques)
1)- L’acide benzoïque :
-
L’acide benzoïque
C6H5–COOH
est utilisé comme conservateur (E 210) dans l’industrie agroalimentaire.
-
Au laboratoire, on
peut préparer l’acide benzoïque à partir de l’alcool benzylique
C6H5 –CH2OH.
2)- Principe de la synthèse.
-
On oxyde l’alcool
benzylique, alcool primaire par l’ion permanganate
MnO4–
(aq) en milieu basique.
-
On utilise le
chauffage à reflux pour accélérer la réaction.
-
L’acide benzoïque est
obtenu sous forme d’ions benzoate C6H5–COO–
(aq) en solution aqueuse.
-
Après séparation de la
phase liquide, on ajoute de l’acide chlorhydrique. L’acide benzoïque précipite
et on le récupère par filtration.
3)- Données :
|
|
M
g / mol |
densité |
qéb
°C |
Solubilité
dans l’eau
à 20 ° C |
Pictogrammes |
|
Alcool
benzylique |
108 |
1,042 |
205 |
40 g / L |
|
|
Acide
benzoïque |
122 |
1,32 |
249 |
2,9 g / L |
|
|
de potassium |
|
|
|
|
|
|
Acide chlorhydrique |
|
|
|
|
|
|
Soude |
|
||||
|
éthanol |
|
4)-
Manipulation :
a)-
Montage et protocole.
-
Chauffage à reflux.
Réaliser le montage suivant et faire le schéma.
Pour
synthétiser l’acide benzoïque, on suit le protocole expérimental suivant :
- Dans le ballon bicol, on introduit un volume V = 2,0 mL de d’alcool benzylique (densité d = 1,042),
- puis 20 mL d’une solution de soude (Na+ (aq) + HO– (aq))
-
et on ajoute quelques grains de pierre ponce pour réguler l’ébullition.
-
Dans l’ampoule de
coulée, on introduit 120 mL d’une solution aqueuse à 0,25 mol / L de
permanganate de potassium (K+
(aq) + MnO4–
(aq)).
-
On porte le mélange à
l’ébullition douce.
-
On introduit goutte à
goutte la solution oxydante tout en maintenant l’ébullition.
-
Lorsque l’addition de
la solution oxydante est terminée, on prolonge l’ébullition douce pendant une
dizaine de minutes.
-
Puis on arrête le
chauffage, tout en maintenant la circulation d’eau et on laisse refroidir.
-
On réduit l’ion
permanganate en excès par l’ajout de quelques millilitres d’éthanol par
l’ampoule de coulée jusqu’à disparition de la teinte violette.
-
On refroidit le ballon
dans un bain d’eau froide.
-
On filtre sur Büchner
le mélange obtenu.
-
On verse le filtrat
dans un erlenmeyer placé dans un cristallisoir qui contient de la glace pilée.
-
On ajoute délicatement
une solution aqueuse d’acide chlorhydrique de concentration
C = 2,0 mol /L.
-
Il se forme un
précipité blanc d’acide benzoïque.
-
Une fois le mélange
bien refroidit, on sur Büchner.
-
On sèche bien le
solide obtenu que l’on place dans un verre de montre.
-
On pèse le solide une
fois sec :
-
Donner la masse
mexp
d’acide benzoïque récupéré :
1)- Le chauffage à reflux : Quelles sont les
caractéristiques du chauffage à reflux ?
|
- Ce montage permet de maintenir le milieu réactionnel à une température constante, en l'occurrence pratiquement
la température d'ébullition du solvant. -
Les vapeurs sont condensées dans le réfrigérant et retournent à l'état
liquide dans le ballon. -
Les réactifs et les produits restent dans le milieu réactionnel. -
Il permet d’accélérer la réaction sans perte de matière. |
2)- Écrire les demi-équations électroniques et l’équation
de la réaction :
|
4
( MnO4–
(aq) +
2
H2O
(ℓ)
+ 3
e –
|
|
3 (
C6H5 –
CH2OH (ℓ)
+
5
HO–
(aq)
|
|
3
C6H5 –CH2OH (ℓ)
+ 4 MnO4–
(aq) →
3
C6H5–COO– (aq) +
4
MnO2
(s)
+
HO– (aq) + 4
H2O
(ℓ)
|
3)- Écrire l’équation de la réaction entre l’ion benzoate
et l’ion hydrogène :
|
C6H5–COO– (aq)
+
5
H+ (aq) →
C6H5–COOH (s) |
4)- Donner le tableau d’avancement de la réaction :
-
Calculer les quantités
de matière initiales de chaque réactif.
-
En déduire le réactif
limitant et l’avancement maximal xmax .
-
Calculer la quantité
de matière d’ions benzoate obtenue : c’est la quantité maximale de d’ions
benzoate attendue.
-
En déduire la quantité
de matière d’acide benzoïque obtenue : c’est la quantité maximale d’acide
benzoïque attendue..
-
En déduire la valeur
du rendement η
de la réaction.
![]() Quantités de matière
initiales :
Quantités de matière
initiales :
-
Quantité de matière
initiale d’alcool benzylique :
-
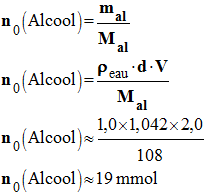
-
n0
(Alcool) ≈ 19
mmol
-
Quantité de matière
initiale d’ions permanganate :
-
n0
(MnO4–)
= C · V
-
n0
(MnO4–)
≈ 120,0 × 10– 3
× 0,25
-
n0
(MnO4–)
≈ 30 mmol
-
Tableau
d’avancement :
|
Équa. |
3
C6H5 –CH2OH (ℓ) |
+ 4 MnO4– (aq) |
→ |
3
C6H5–COO– (aq) |
+ 4
MnO2
(s) |
+ HO–
(aq) |
+
4 H2O
(ℓ) |
|
|
mmol |
mmol |
|
|
mmol |
mmol |
mmol |
|
État
i |
n0
(Alcool) ≈ 19 |
n0
(MnO4–)
≈ 30 |
|
0 |
0 |
– |
– |
|
État
x |
n0
(Alcool) – 3 x |
n0
(MnO4–)
– 4 x |
|
3
x |
4
x |
– |
– |
|
État
max |
n0
(Alcool) – 3 xmax |
n0
(MnO4–)
– 4 xmax |
|
3
xmax |
4
xmax |
– |
– |
![]() Réactif limitant et
avancement maximal :
Réactif limitant et
avancement maximal :
-
Hypothèse 1 :
l’alcool est le réactif limitant
-
Alors : n0
(Alcool) – 3
xmax1
= 0
-
xmax1 =
n0
(Alcool) / 3
-
xmax1 ≈ 6,3 mmol
-
Hypothèse 2 : le
réactif limitant est l’ion permanganate :
-
n0
(MnO4–)
– 4 xmax2
= 0
-
xmax2 =
n0
(MnO4–)
/ 4
-
xmax2 ≈ 7,5 mmol
-
Valeur de l’avancement maximal
xmax :
-
Il est égal à la
plus petite des deux valeurs :
-
xmax =
xmax1
≈ 6,3 mmol < xmax2
≈ 7,5 mmol
-
Le réactif limitant
est l’alcool.
- Maintenant, on peut compléter le tableau d’avancement : xmax ≈ 6,3 mmol
|
Équa. |
3
C6H5–CH2OH (ℓ) |
+ 4 MnO4– (aq) |
→ |
3
C6H5–COO– (aq) |
+ 4
MnO2
(s) |
+ HO–
(aq) |
+
4 H2O
(ℓ) |
|
|
mmol |
mmol |
|
|
mmol |
mmol |
mmol |
|
État
i |
n0
(Alcool) ≈ 19 |
n0
(MnO4–)
≈ 30 |
|
0 |
0 |
– |
– |
|
État
x |
n0
(Alcool) – 3 x |
n0
(MnO4–)
– 4 x |
|
3
x |
4
x |
– |
– |
|
État
max |
0 |
4,8 |
|
19 |
25 |
– |
– |
![]() Quantité de matière
d’ions benzoate obtenue : c’est la quantité maximale d’ions benzoate attendue.
Quantité de matière
d’ions benzoate obtenue : c’est la quantité maximale d’ions benzoate attendue.
-
nmax (Benzaoate) ≈ 19 mmol
![]() Quantité de matière
d’acide benzoïque obtenue : c’est la quantité maximale d’acide benzoïque
attendue.
Quantité de matière
d’acide benzoïque obtenue : c’est la quantité maximale d’acide benzoïque
attendue.
-
Lors de la
réaction :
|
C6H5–COO– (aq) +
5
H+ (aq)
→
C6H5–COOH (s) |
-
Les ions hydrogène
H+
(aq) sont introduits en excès :
-
En conséquence : nmax
(Benzaoate) = nmax
(Acide benzoïque) ≈ 19 mmol
-
Masse d’acide
benzoïque attendue :
-
mmax (Acide benzoïque) =
nmax
(Acide benzoïque) . M
(Acide benzoïque)
-
mmax
(Acide benzoïque) ≈ 19 × 10– 3
× 122
-
mmax
(Acide benzoïque) ≈ 2,3 g
![]() Rendement de la
réaction :
Rendement de la
réaction :
-
On a obtenu une masse
mexp
= 1,9 g.
-

-
Le rendement obtenu
est de 83%. Il est inférieur à 100%.
-
Plusieurs causes
peuvent expliquer ce résultat :
-
L'avancement
maximal n'était peut-être pas atteint.
-
De l'acide
benzoïque reste dissout dans l'eau et ne cristallise pas.
-
Le rinçage du
précipité à l'eau distillée peut dissoudre une petite quantité d'acide benzoïque
cristallisé.
-
Pour purifier
l’acide benzoïque obtenu, on peut utiliser une méthode assez simple :
-
la
recristallisation.
5)- Comment
peut-on caractériser le produit synthétisé ?
-
On peut réaliser
une
C.C.M.
-
On peut déterminer
la valeur de la température de fusion au banc Kofler.
|
|