|
|
Les réactions de combustion |
|
|
|
|
|
II- La conversion
de l’énergie. |
|
1)- Le pouvoir calorifique d’un combustible.
QCM r
|
|
Séance de travaux pratiques : Détermination du pouvoir calorifique d'un combustible : l'éthanol |
|
1)- Exercice 03
page 164 : Écrire l’équation d’une réaction de combustion. 2)- Exercice 05
page 164 : Calculer une énergie libérée. 3)- Exercice 07
page 164 : Déterminer une énergie de liaison. 4)- Exercice 08
page 164 : Estimer une énergie de combustion. 5)- Exercice 09
page 165 : Choisir un combustible. 6)- Exercice 11
page 165 : Élimination du CO2
d’un véhicule GPL. 7)- Exercice 12
page 165 :Composition du carburant E15. 8)- Exercice 15
page 166 : Valeur énergétique d’une amande. 9)- DS N° 01 :
Exercice 16 page 167 : Quel carburant pour les véhicules « Flex-fuel » ?
(40 min) 10)- DS N° 02 :
Exercice 17 page 167 : À propos du « gaz à l’eau » (15 min) |
-
La réaction de
combustion est une réaction d’oxydoréduction au cours de laquelle :
-
Un combustible
s’oxyde ;
-
Un comburant,
généralement le dioxygène O2
(g), se réduit.
-
Remarque :
-
Pour activer la
réaction de combustion, une énergie doit être apportée.
-
En conclusion :
-
La combustion
nécessite :
-
Un combustible ;
-
Un comburant ;
-
Et une activation
énergétique.
|
- La combustion d’un combustible ne contenant que les éléments carbone C, hydrogène H et éventuellement oxygène O, est dite complète
si les produits de la réaction sont uniquement le dioxyde de
carbone CO2
et l’eau H2O. |
-
Si lors de la réaction
de combustion la quantité de dioxygène est insuffisante, la combustion est alors
incomplète.
-
Il se forme alors deux
produits supplémentaires :
-
Le
carbone C
-
Et le monoxyde de
carbone CO.
-
Le monoxyde de carbone
est un gaz incolore, inodore et très toxique.
-
La gravité de
l’intoxication dépend de la quantité de CO fixée par l’hémoglobine.
-
Les premiers symptômes
et les plus fréquents sont : maux de têtes,
nausées , vomissements.
|
Concentrations
dans l'air |
||
|
CO
(ppm) |
% CO dans
l'air |
Symptômes |
|
3200 |
0,32 |
Maux de tête,
vertiges,
nausées après 5
min,
perte de
connaissance
après 30 min |
|
6400 |
0,64 |
Céphalées et
vertiges
après 1 à 2 min,
perte de
connaissance
après 10-15 min |
|
12800 |
1,28 |
Perte de
connaissance
immédiate, décès
en
1 à 3 minutes |
-
ppm : (parties par
million)
-
ppm : Nombre de
molécules de monoxyde de carbone CO
par million de « molécules (N2 et O2)» d’air.
-
Ainsi l’air à 3200 ppm
de CO ,
signifie qu'il y a 3200 molécules de monoxyde de carbone
CO sur 1 million de
« molécules (N2 et O2) » d'air.
-
L’air est un mélange
principalement de molécules de diazote N2
et de dioxygène O2.
►
Combustion du
propane :
|
Équation |
C3H8
(g) |
+
5 O2
(g) |
→ |
3 CO2
(g) |
+ 4
H2O
(ℓ) |
|
|
État du
système |
Avancement |
|
|
|
|
|
|
État initial
(mol) |
x
=
0 |
n1
|
n2
|
0 |
0 |
|
|
Au cours de la
transformation |
x |
n1
– x |
n2
– 5 x |
3 x |
4 x |
|
|
État final
(mol) |
x =
xmax |
n1
– xmax |
n2
– 5 xmax |
|
3
xmax |
4 xmax |
-
Relation pour un
mélange stœchiométrique :
|
Équation |
C3H8
(g) |
+ 5
O2
(g) |
→ |
3 CO2
(g) |
+ 4
H2O
(ℓ) |
|
|
État du système |
Avanc.
mmol |
n
(C3H8) |
n
(O2) |
|
||
|
État initial |
x =
0 |
n0
(C3H8)
= n1 |
n0
(O2)
= n2 |
|
||
|
Coefficients stœchiométriques |
1 |
5 |
3 |
4 |
||
-
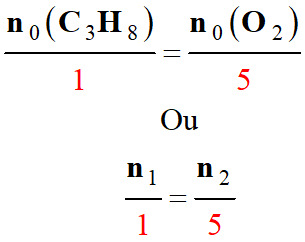
►
Combustion de
l’éthanol :
-
L'éthanol (alcool
éthylique) est l’alcool que l'on retrouve dans les boissons alcoolisées.
-
Des petites quantités
d'éthanol provoquent un état euphorique.
-
Des doses plus
importantes dépriment gravement le système nerveux
|
C2H6O
(ℓ) + 3
O2 (g) |
→ |
2
CO2 (g) +
3 H2O
(g) |
-
Relation pour un
mélange stœchiométrique :
|
Équation
chimique |
C2H6O
(ℓ) + 3
O2 (g) → 2
CO2 (g) +
3 H2O
(g) |
||||
|
Espèces chimiques |
C2H6O
(ℓ) |
O2
(g) |
|
CO2
(g) |
H2O
(g) |
|
Quantité de matière |
n
(C2H6O)
|
n
(O2) |
|
n
(CO2) |
n
(H2O) |
|
Coefficients stœchiométriques |
1 |
3 |
|
2 |
3 |
-
![]()
4)- Les différents combustibles :
-
Parmi les
combustibles, on distingue :
-
Les combustibles
fossiles : pétrole, charbon, méthane
-
Ces combustibles ne
sont pas renouvelables à l’échelle humaine.
-
Ressources :
-
200 ans pour le
charbon ;
-
60 ans pour le gaz
naturel ;
-
40 ans pour le
pétrole.
-
Les combustibles
fossiles massivement utilisés actuellement dégagent beaucoup de gaz à effet de
serre impliqués dans le réchauffement climatique.
-
Les agrocombustibles :
éthanol, ester méthylique de colza, agrométhane, bois
-
Ces produits sont
obtenus à partir de la biomasse et sont renouvelables à l’échelle humaine.
►
Une définition pour la
ressource renouvelable :
-
Lorsque le stock de
ressource énergétique se reconstitue aussi vite qu’il ne disparaît ou lorsque
cette ressource est quasi illimitée (à notre échelle de temps),
-
On dit que cette
ressource est renouvelable.
►
Une définition pour la
ressource non renouvelable :
-
Lorsque le stock de
ressource énergétique se reconstitue beaucoup moins vite qu’il ne disparaît ou
lorsque cette ressource ne se reconstitue pas du tout,
-
On dit que cette
ressource est non renouvelable.
II-
La conversion de l’énergie.
1)- Énergie transférée lors d’une combustion.
-
Lors de la combustion,
le système chimique contenant le combustible libère de l’énergie Q ( en joule
J).
-
Les réactions de
combustion sont des transformations exothermiques :
-
Q
< 0.
►
Énergie molaire de
combustion Ecomb :
-
Énergie transférée
lors de la combustion d’une mole de combustible.
-
C’est une grandeur
négative :
-
Ecomb <
0
-
Unité :
joule par mole (J . mol–1)
►
Énergie
transférée Q
par la combustion d’une quantité n
de combustible :
-
Q =
n .
Ecomb
-
Tableau :
|
Q =
n . Ecomb |
Q :
Énergie transférée en joule (J) |
|
n :
Quantité de matière de
combustible en mole (mol) |
|
|
Ecomb
: Énergie molaire de combustion en joule par mole (J . mol–1) |
-
L’énergie transférée
Q peut aussi
se calculer à partir du pouvoir calorifique PC :
►
Pouvoir calorifique
PC d’un
combustible :
-
C’est l’énergie que
l’on peut récupérer lors de la combustion d’un kilogramme de combustible.
-
Cette grandeur est
positive :
-
PC
> 0
-
Unité :
joule par kilogramme (J . kg–1)
►
Énergie transférée
Q par la
combustion d’une masse m
de combustible :
-
Q
= – m
. PC
-
Tableau :
|
Q =
– m . PC |
Q :
Énergie transférée en joule (J) |
|
m :
Masse de combustible en kilogramme (kg) |
|
|
PC
: Pouvoir calorifique du combustible joule par kilogramme (J . kg–1) |
►
Les signes pour les
énergies :
-
Ecomb <
0
-
Cette énergie est
définie par rapport au système chimique qui contient le combustible.
-
Le système chimique
est le système de référence.
-
Il cède de l’énergie
au milieu extérieur.
-
PC
> 0
-
Le pouvoir calorifique
est défini par rapport au système chauffé (le plus souvent le milieu extérieur)
-
Le système chauffé
reçoit de l’énergie.
►
Relation entre
Ecomb et
PC :
-
Q
= n . Ecomb
-
Q
= – m . PC
-
n
. Ecomb
= – m
. PC
-
Si on considère un
combustible de masse molaire M :
-
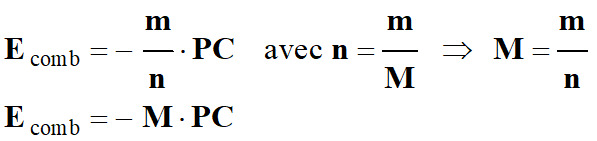
-
Tableau :
|
Ecomb
= – M . PC |
Ecomb
: Énergie molaire de combustion en joule par mole (J . mol–1) |
|
M :
Masse molaire du
combustible en kilogramme
par mole (kg . mol–1) |
|
|
PC
: Pouvoir calorifique du combustible joule par kilogramme (J . kg–1) |
2)-
Énergie molaire de combustion et énergie de liaison.
a)-
Énergie
de liaison Eℓ
d’une liaison covalente A
–
B :
-
L’énergie de liaison
Eℓ
d’une liaison covalente A
– B,
est l’énergie nécessaire pour rompre une mole de liaisons et libérer les atomes
isolés A et
B à l’état
gazeux.
b)-
Tableau des valeurs de
quelques énergies de liaison :
|
Liaison |
Énergie de
liaison
Eℓ en (kJ . mol–1) |
|
C – H |
413 |
|
C – C |
348 |
|
C – O |
360 |
|
O = O |
496 |
|
O – H |
463 |
|
C = O |
804 |
|
C = O dans
CO2 |
796 |
c)-
Calcul de l’énergie molaire
de combustion :
-
Lors de la combustion
d’un combustible, des liaisons se rompent et d’autres se
forment.
-
Ces modifications des
structures moléculaires sont à l’origine de l’énergie molaire de combustion.
-
Pour calculer
l’énergie molaire de combustion :
-
On écrit l’équation de
combustion du combustible,
-
Dans cette équation,
le combustible doit avoir un nombre stœchiométrique égal à
1.
►
Diagramme
énergétique :
-
Énergie molaire de
combustion :
-
À partir du diagramme
énergétique, on peut en déduire que :
|
Ecomb
= |
[ |
somme
des énergies
de liaisons rompues |
] |
– |
[ |
somme des
énergies de
liaisons formées |
] |
-
Les réactions de
combustion sont exothermiques : elles libèrent plus d’énergie qu’elles n’en
consomment.
-
Ecomb
< 0.
d)-
Exemple 1 : Calculer
l’énergie molaire de combustion du méthane CH4 :
-
Équation de
combustion :
|
1
CH4
(g) +
2 O2
(g) |
→ |
1
CO2 (g) +
2
H2O (g) |
-
Structure moléculaire
des molécules des réactifs :
|
Méthane |
Dioxygène |
|
|
O
= O |
-
Au cours de la
combustion d’une mole de méthane :
-
1
× 4 moles liaisons C – H
et 2
× 1 moles de liaisons O = O
sont rompues.
-
Eℓrompues
= 4
× Eℓ
(C – H)
+ 2
× Eℓ
(O = O)
-
Eℓrompues
= 4
× 413 + 2
× 496
-
Eℓrompues
≈ 2,644
× 103 kJ . mol–1
-
Eℓrompues
≈ 2,64 × 103 kJ . mol–1
-
Structure moléculaire
des produits :
|
Eau |
Dioxyde
de carbone |
|
H
— O
—
H |
O
= C
=
O |
-
Au cours de la
combustion d’une mole de méthane :
-
1
× 2 moles de liaisons C = O
et 2
× 2
moles de
liaisons H – O
sont formées.
-
Eℓformées
= 2
× Eℓ
(C = O)
+ 2
× 2 × Eℓ
(H – O)
-
Eℓformées
= 2
× 796 + 2
× 2 × 463
-
Eℓformées
= 3,444
× 103
kJ . mol–1
-
Eℓformées
= 3,44 × 103
kJ . mol–1
-
Énergie molaire de
combustion du méthane :
-
Ecomb
(CH4)
= Eℓrompues
– Eℓformées
-
Ecomb
(CH4)
≈ 2,64 × 103 –
3,44
× 103
-
Ecomb
(CH4)
≈
– 800 kJ . mol–1
e)-
Exemple 2 : Calculer
l’énergie molaire de combustion du méthanol CH4O :
-
Équation de la
réaction :
|
2
CH4O
(ℓ) +
3 O2
(g) |
→ |
2 CO2
(g) +
4 H2O
(g) |
|
1
CH4O
(ℓ) + |
→ |
1 CO2
(g) +
2 H2O
(g) |
-
Dans cette équation,
le combustible doit avoir un nombre stœchiométrique égal à
1.
-
Structure moléculaire
des molécules des réactifs et des produits :
|
Méthanol |
Dioxygène |
Eau |
Dioxyde de
carbone |
|
|
O
= O |
H
— O
—
H |
O
= C
=
O |
-
Énergie des liaisons
concernées :
|
Liaisons |
C
–
H |
C
–
O |
O
= O |
H
– O |
C
= O
dans CO2 |
|
Eℓ
(kJ . mol–1) |
413 |
360 |
496 |
463 |
796 |
-
Au cours de la
combustion d’une mole de méthanol,
-
Les
liaisons rompues :
-
1
× 3 moles de liaisons
C – H
-
1
× 1 mole de liaisons C
– O
-
1
× 1 mole de liaisons H
– O
- ![]() × 1 mole de liaison
O
=
O
× 1 mole de liaison
O
=
O
-
Eℓrompues
= 3
× Eℓ
(C – H)
+ 1
× Eℓ
(C – O)
+ 1
× Eℓ
(O – H)
+
![]() ×
Eℓ
(O = O)
×
Eℓ
(O = O)
-
Eℓrompues
= 3
× 413 + 1
× 360 + 1
× 463 +
![]() ×
496
×
496
-
Eℓrompues
≈ 2,806
× 103 kJ . mol–1
-
Eℓrompues
≈ 2,81 × 103 kJ . mol–1
-
Au cours de la
combustion d’une mole de méthanol,
-
Les liaisons formées :
-
1
× 2 moles de liaisons C = O
-
2
× 2
moles de
liaisons H – O
-
Eℓformées
= 2
× Eℓ
(C = O)
+ 2
× 2 × Eℓ
(H – O)
-
Eℓformées
= 2
× 796 + 2
× 2 × 463
-
Eℓformées
= 3,444
× 103
kJ . mol–1
-
Eℓformées
= 3,44 × 103
kJ . mol–1
-
Énergie molaire de
combustion du méthanol :
-
Ecomb
(CH4O)
= Eℓrompues
– Eℓformées
-
Ecomb
(CH4O)
≈ 2,81 × 103 –
3,44
× 103
-
Ecomb
(CH4O)
≈
– 638 kJ . mol–1
-
Remarque : les calculs
intermédiaires restent dans la mémoire de la calculatrice et ne sont pas
arrondis.
-
Si les résultats
intermédiaires sont arrondis, on trouve :
-
Ecomb
(CH4O)
≈
– 630 kJ . mol–1
III-
Les enjeux des réactions de combustion.
-
Lors des réactions
chimiques, les molécules libèrent ou captent de l’énergie : on dit qu’elles
contiennent de l’énergie chimique.
-
L’énergie contenue
dans une molécule organique peut être libérée par une réaction chimique : on
parle d’énergie chimique.
-
Les hydrocarbures et
les alcools constituent des stocks d’énergie chimique.
-
Les réactions de
combustion permettent d’obtenir de l’énergie thermique.
|
Énergie chimique |
Combustion
→ |
Énergie thermique |
-
On doit à Lavoisier
l’interprétation des phénomènes de combustion comme des réactions
d’oxydoréduction.
-
L’énergie chimique
dépend des liaisons rompues et formées au cours d’une réaction chimique.
-
Une réaction de
combustion est toujours exothermique : le système chimique libère de l’énergie.
-
Les réactions de
combustion émettent des gaz polluants à effet de serre.
|
- Gaz à effet de serre : Gaz absorbant les rayonnements IR
émis par la surface terrestre et contribuant à l’effet de serre. |
-
L’augmentation de leur
concentration dans l’atmosphère terrestre serait à l’origine du réchauffement
climatique récent
-
En conséquence, les
réactions de combustion participent au réchauffement climatique.
-
Il existe plusieurs
gaz à effet de serre (GES)
.
-
Le dioxyde de carbone
CO2
est le plus connu.
-
Il sert de référence.
-
Par
exemple, le méthane présent dans le gaz
naturel est aussi un gaz à effet de serre :
-
Équivalence : 1 kg de
méthane CH4
agit comme l’équivalent de 21 kg de
CO2.
|
- Avec la raréfaction annoncée du pétrole et du gaz naturel (et donc l’augmentation inévitable de leurs prix), les controverses autour des centrales nucléaires et la difficile émergence des énergies renouvelables,
la production d’énergie (notamment
électrique) à partir du charbon, bon marché et abondant, |
-
Malheureusement,
l’utilisation de ce combustible produit énormément de dioxyde de carbone, gaz à
effet de serre.
-
Des méthodes de «
captage-stockage », pour empêcher le dioxyde de carbone de s’échapper dans
l’atmosphère, sont à
l’étude.
-
Les méthodes de
captage différent selon le type de centrale utilisé.
-
Dans les centrales
classiques qui brûlent du charbon pour transformer l’eau liquide en vapeur pour
faire tourner des turbines génératrices d’électricité, le captage ne peut se
faire qu’en sortie de cheminée.
-
L’utilisation des
biodiesels pourrait permettre de réduire les émissions de gaz à effet de serre (GES)
jusqu’à 50 % (du puits à la roue) par rapport aux combustibles fossiles dans
lesquels ils sont incorporés.
|
Les enjeux du XXIe siècle
-
Il est nécessaire :
-
D’assurer un
approvisionnement suffisant et sûr,
-
De réduire la
dépendance envers les importations d’énergie,
-
De réaliser des
investissements dans les nouvelles technologies : - Énergie éolienne, Énergie solaire, Géothermie,
- Développement des centrales nucléaires de quatrième
génération, …
-
De réaliser des
économies d’énergie dans l’habitat,
-
De réduire les gaz à
effets de serre,
-
De limiter, récupérer,
traiter et valoriser les déchets,
-
De développer de
nouvelles ressources énergétiques.
|
1)- Le pouvoir calorifique d’un combustible : L'éthanol
-
On utilise une canette
ayant contenu une boisson (33 cl)
-
Cette
canette est remplie d’une quantité connue
d’eau.
-
L’ensemble est chauffé
à l’aide d’une
lampe à éthanol.
-
On mesure la masse de
la lampe au début et à la fin de la manipulation.
-
On mesure également,
l’élévation de température.
-
On en déduit
expérimentalement la valeur de la chaleur de combustion.
-
Données :
|
|
Masse
volumique
(g . mL–1) |
Capacité
thermique
massique
(J . kg–1 . ° C–1) |
Sécurité |
|
Eau |
1,00 |
4180 |
/ |
|
Éthanol |
0,789 |
2460 |
|
|
Aluminium |
2,7 |
0,897 |
/ |
-
Capacité thermique massique de l’aluminium :
Cal
= 0,897 J . kg–1
. ° C–1
-
Température de vaporisation de l’éthanol sous la pression atmosphérique :
θi
= 79 ° C
-
Chaleur latente de
vaporisation de l’éthanol :
Lv
=
855 kJ . kg–1
-
Pour le
calcul des quantités de chaleur
Q :
-
Un
objet de masse m dont la température varie de
θi
à θf
sans changer d’état physique est le siège d’un transfert d’énergie
Q :
|
Q
= m . c . (θf – θi) |
Q :
transfert d’énergie en joule (J) |
|
m :
la masse de l’objet en gramme (g) |
|
|
c :
capacité thermique massique du matériau constituant
l’objet : (J . g–1. ° C–1)
|
|
|
θf
et θi : température en degré Celsius (° C–1) |
-
Masse molaire atomique du
carbone : M
(C)
= 12,0 g . mol–1
-
Masse molaire atomique de
l’hydrogène :
M
(H)
= 1,01 g . mol–1
-
Masse molaire atomique de
l’oxygène :
M
(O)
= 16,0 g . mol–1
-
L’éthanol est un
alcool primaire qui est utilisé dans le domaine médical comme antiseptique (gel
hydroalcoolique).
-
Il est utilisé en
parfumerie comme solvant.
-
L’éthanol est un
biocarburant car il est produit à partir de matières premières agricoles
(betterave, maïs, canne à sucre,…).
-
Alcool primaire :
CH3
– CH2
– OH
-
L’éthanol est aussi un
combustible utilisé pour chauffer l’habitat et plus connu sous son nom d’usage
d’alcool.
-
On le trouve dans
certaines lampes, des chauffe-plats et certains poêles d’appoint.
-
Sa combustion donne
une flamme bleutée.
-
Schéma du montage :
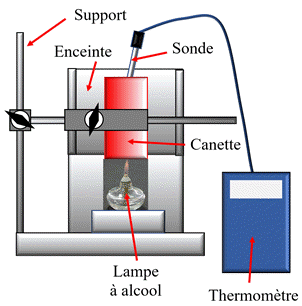
![]() Le protocole :
Le protocole :
-
Peser
la lampe à éthanol et noter sa masse
mi
-
Préparer
200 mL d’eau du robinet.
-
Remplir la canette
avec les 200 mL d’eau
-
Suspendre la canette,
introduire la sonde du thermomètre et noter alors la température initiale
θi
(attendre l’équilibre thermique)
-
Introduire la lampe à
alcool sous le bécher et allumer la lampe.
-
Surveiller la
température de l’eau et arrêter le chauffage quand la température est d’environ
20° C supérieure à la température initiale.
-
Noter la température
finale, (θf)
après avoir homogénéiser l’eau (c’est la température maximale atteinte).
-
Peser
la lampe à alcool et noter sa masse finale
mf.
-
En
déduire la masse m d’éthanol consommée.
-
Indiquer le
fonctionnement de la lampe à alcool et préciser le rôle de la mèche présente
dans la lampe :
-
Les mesures :
|
Masse de la canette d’aluminium : |
mal
= 28,95 g |
|
Masse d’eau placée dans la canette :
|
meau
= 200 g |
|
Masse initiale de la lampe :
|
mi
=144,1 g |
|
Masse finale de la lampe : |
mf
= 143,2 g |
|
Température initiale de l’eau :
|
θi
=
20,8 ° C |
|
Température finale de l’eau :
|
θf
=
39,8 ° C |
d)-
Exploitation
des mesures :
-
Calculer la masse m d’éthanol consommé.
-
Calculer la masse molaire M de l’éthanol.
-
Calculer la quantité de matière
n d’éthanol consommé.
-
Calculer la masse meau
d’eau chauffée.
-
Calculer la quantité de chaleur
Q1 qui
sert à chauffer l’eau.
-
Calculer la quantité de chaleur
Q2 qui
sert à chauffer la canette d’aluminium.
-
Calculer la quantité de chaleur
Q dégagée par la combustion de
l’éthanol en kJ.
e)-
Étude de la réaction de
combustion :
-
On considère que la
combustion de l’éthanol est complète.
-
Écrire l’équation de
la combustion de l’éthanol.
-
Réaliser un tableau
d’avancement.
-
Calculer l’énergie molaire de combustion
Ecomb
de l’éthanol.
-
Structure moléculaire
des molécules des réactifs et des produits :
|
Éthanol |
Dioxygène |
eau |
Dioxyde de
carbone |
|
|
O
= O |
H
— O
—
H |
O
= C
=
O |
-
Quelques énergies de
liaisons :
|
Liaison |
Énergie de
liaison
Eℓ en (kJ . mol–1) |
|
C – H |
413 |
|
C – C |
348 |
|
C – O |
360 |
|
O = O |
496 |
|
O – H |
463 |
|
C = O |
804 |
|
C = O dans CO2 |
796 |
-
Comparer cette valeur
à celle déterminée expérimentalement et conclure.
QCM r
|
1)- Exercice 03
page 164 : Écrire l’équation d’une réaction de combustion. 2)- Exercice 05
page 164 : Calculer une énergie libérée. 3)- Exercice 07
page 164 : Déterminer une énergie de liaison. 4)- Exercice 08
page 164 : Estimer une énergie de combustion. 5)- Exercice 09
page 165 : Choisir un combustible. 6)- Exercice 11
page 165 : Élimination du CO2
d’un véhicule GPL. 7)- Exercice 12
page 165 :Composition du carburant E15. 8)- Exercice 15
page 166 : Valeur énergétique d’une amande. 9)- DS N° 01 :
Exercice 16 page 167 : Quel carburant pour les véhicules « flex-fuel » ?
(40 min) 10)- DS N° 02 :
Exercice 17 page 167 : À propos du « gaz à l’eau » (15 min) |
|
|