|
Les réactions de combustion |
|
|
|
|
|
Les réactions de combustion
![]()
|
QCM N°
09
La réaction de
combustion
La conversion de
l’énergie
Les enjeux des
réactions de combustion
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
La réaction de
combustion du bois dans
l’air est possible
grâce : |
Au diazote |
Au dioxygène |
À la
vapeur d’eau |
B |
|
2 |
Les
agrocombustibles sont des
combustibles : |
Issus de
la biomasse |
Produit par
l’agriculture |
fossiles |
AB |
|
3 |
La combustion
complète du propane
C3H8 produit : |
Du dioxyde
de carbone
et de l’eau |
Du dioxyde
de carbone
et du carbone |
Du méthane
CH4. |
A |
|
4 |
L’équation de
la combustion
complète du butane
s’écrit : |
C4H10 (g)
+ 9 O2 (g)
↓ 4 CO2 (g)
+ 5 H2O (g) |
2 C4H10 (g)
+ 13 O2 (g)
↓ 8 CO2 (g)
+ 10 H2O (g) |
2 C4H10 (g)
+ 5 O2 (g)
↓ 8 C (g)
+
10 H2O (g) |
B |
|
5 |
D’après la
réponse à la question
4, la combustion
complète de 3 mol de
butane : |
Produit 12 mol
de dioxyde
de carbone |
Consomme
21 mol
de dioxygène |
Produit
15 mol
d’eau |
AC |
|
6 |
Une réaction
de combustion :
|
Libère de
l’énergie. |
Consomme
davantage
d’énergie
qu’elle n’en
libère |
Consomme moins
d’énergie qu’elle
n’en libère |
AC |
|
7 |
La combustion
de 2 mol de butane
libère 5,4 MJ. L’énergie
molaire de combustion du
butane est égale à :
|
–2,7
MJ . mol–1 |
–2,7 × 103
kJ . mol–1 |
–10,8
MJ . mol–1 |
AB |
|
8 |
L’énergie
libérée lors d’une
combustion dépend :
|
De la nature du
combustible |
De la nature du
comburant |
De la masse de
combustible |
ABC |
|
9 |
Lorsqu’une
liaison est rompue : |
De l’énergie
est reçue |
Aucun
transfert
d’énergie
n’a lieu |
De l’énergie
est libérée |
A |
|
10 |
La réaction de
combustion du
méthane
d’équation : CH4 (g) + 2 O2 (g) ↓
CO2
(g) + 2 H2O (g) Lors de la
combustion d’une mole de
méthane :
|
3 mol
de liaisons
C = O sont
créées |
5 mol
de liaisons
O = O sont
rompues |
4 mol
de liaisons
H – O sont
créées |
C |
|
11 |
Une réaction
de combustion
fournit de l’énergie
lors du
fonctionnement : |
D’une voiture
à essence |
D’un avion
de ligne |
D’un
smartphone |
AB |
|
12 |
Pour diminuer
les émissions de
gaz à effet de
serre, il faut utiliser
davantage : |
De
combustibles
fossiles |
D’agro-
-combustibles |
De charbon |
B |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
La réaction de combustion :
La combustion complète :
Combustion du propane :
|
Équation |
C3H8
(g) |
+
5 O2
(g) |
→ |
3 CO2
(g) |
+
4 H2O
(ℓ) |
|
|
État du
système |
Avancement |
|
|
|
|
|
|
État initial
(mol) |
x =
0 |
n1
|
n2
= |
0 |
0 |
|
|
Au cours de la
transformation |
x |
n1
– x |
n2
– 5 x |
3 x |
4 x |
|
|
État final
(mol) |
x =
xmax |
n1
– xmax |
n2
– 5 xmax |
|
3
xmax |
4 xmax |
|
Équation |
C3H8
(g) |
+ 5
O2
(g) |
→ |
3 CO2
(g) |
+
4 H2O
(ℓ) |
|
|
État du
système |
Avanc.
mmol |
n
(C3H8) |
n
(O2) |
n
(CO2) |
n
(H2O) |
|
|
Coefficients
stœchiométriques |
1 |
5 |
3 |
4 |
||
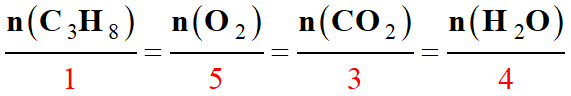
Les différents combustibles :
Énergie transférée lors d’une combustion.
Énergie molaire de combustion Ecomb :
Énergie transférée Q par la combustion d’une
quantité n de combustible :
|
Q
= n . Ecomb |
Q :
Énergie transférée en joule (J) |
|
n :
quantité de matière de
combustible en mole (mol) |
|
|
Ecomb
: Énergie molaire de combustion en joule par mole (J . mol–1) |
Pouvoir calorifique PC d’un combustible :
Énergie transférée Q par la combustion d’une masse
m de combustible :
|
Q
= – m . PC |
Q :
Énergie transférée en joule (J) |
|
m :
masse de combustible en kilogramme (kg) |
|
|
PC
: pouvoir calorifique du combustible joule par kilogramme (J . kg–1) |
Les signes pour les énergies :
Relation entre Ecomb et PC :
|
Ecomb
= – M . PC |
Ecomb
: Énergie molaire de combustion en joule par mole (J . mol–1) |
|
M :
masse molaire du
combustible en kilogramme
par mole (kg . mol–1) |
|
|
PC
: pouvoir calorifique du combustible joule par kilogramme (J . kg–1) |
Calcul de l’énergie molaire de combustion :
|
Ecomb
= |
[ |
somme des énergies
de liaisons rompues |
] |
– |
[ |
somme
des énergies de
liaisons formées |
] |
Combustion et énergie.
|
Énergie chimique |
Combustion
→ |
Énergie thermique |
Combustion et pollution.
|
|