|
|
Cohésion de la matière Cours |
|
|
|
|
|
I- La cohésion d’un solide
ionique ou moléculaire. |
|
II- La solubilité d’une
espèce chimique. 2)- Solubilité d’un soluté
dans un solvant.
|
|
III- Extraction par un
solvant d’une espèce chimique en solution. |
|
1)- Cohésion des molécules
d’eau dans la glace.
La
cohésion d’un solide ionique ou moléculaire.
La
solubilité d’une espèce chimique.
L’extraction par un solvant d’une espèce en solution. |
|
1)-
Exercice 04 page 112 : Expliquer la cohésion d’un
solide. 2)-
Exercice 06 page 112 : Justifier une solubilité.
3)-
Exercice 07 page 112 : Prévoir une solubilité. 4)-
Exercice 08 page 113 : Écrire des équations de réaction
de dissolution. 5)- Exercice 12 page 113 : Calculer la concentration en quantité de matière d’un ion à partir de la masse d’un solide. 6)-
Exercice 13 page 113 : Calculer la masse d’un solide à
dissoudre. 7)-
Exercice 16 page 114 : Choisir un solvant d’extraction
adapté. 8)-
Exercice 21 page 115
: Solubilité de molécules organiques 9)-
Exercice 24 page 116 : Un traitement de la vigne. 10)-
Exercice 26 page 117 :DS (40 min) Traiter une carence en calcium. 11)- Exercice 27 page 117 : DS (20 min) Du soufre dans les hydrocarbures. |
I- La cohésion d’un solide
ionique ou moléculaire.
1)- Cohésion d’un solide
ionique.
a)-
Exemple : Le chlorure de sodium.
-
Le
chlorure de sodium est constitué d’un assemblage compact et ordonné d’ions
sodium et d’ions chlorure.
-
La
formule statistique du cristal est : NaCℓ.
-
Le
cristal est électriquement neutre. Il contient autant d’ions sodium
Na +
que d’ions chlorure Cℓ–.
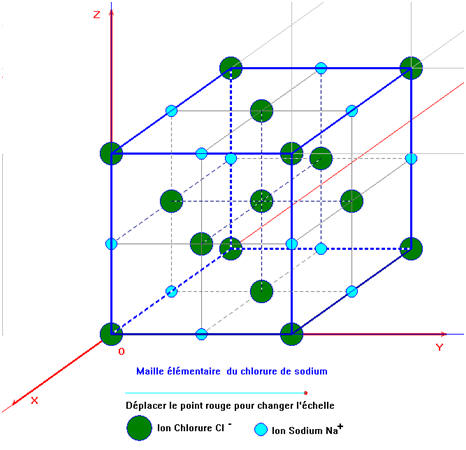 |
-
Cette
maille élémentaire se reproduit dans les trois directions de l’espace.
 |
-
Chaque
ion se trouve en contact avec des ions de signes contraires.
-
Il en
résulte une structure régulière dans laquelle un motif se répète à des millions
d’exemplaires. Le motif est appelé maille élémentaire.
-
On
obtient un cristal à l’échelle macroscopique.
 |
b)-
Le
cristal ionique.
-
Un solide
ionique est constitué d’un assemblage compact et ordonné de cations et d’anions.
-
Il est
électriquement neutre.
-
Dans un
solide ionique, chaque ion de charge qA est entouré d’ions de charge
qB de signe opposé.
-
L’interaction électrostatique attractive entre ces ions assure la cohésion du
solide ionique.
-
La
cohésion du cristal ionique est due aux forces d’interactions électriques :
-
Les
forces d’attraction électriques entre les ions de signes opposés l’emportent sur
les forces de répulsion entre les ions de même signe.
-
Cas du
cristal de chlorure de sodium :
-
Toutes
les attractions et toutes les répulsions n’ont pas été représentées.
-
Les
forces d’attraction électriques entre les ions de signes opposés l’emportent sur
les forces de répulsion entre les ions de même signe.
c)-
Application :
►
La fluorine est un cristal ionique constitué d’un
empilement compact et ordonné d’ions calcium et d’ions fluorure
F–.
 |
►
Les ions calcium proviennent d’un atome de
calcium ayant perdu deux électrons.
![]() Écrire la formule de l’ion calcium et en déduire
la formule statistique et le nom de la fluorine.
Écrire la formule de l’ion calcium et en déduire
la formule statistique et le nom de la fluorine.
-
Réponse :
-
L’ion
calcium porte une charge électrique positive :
Ca2+
-
Le
cristal est électriquement neutre, il faut un ion calcium
Ca2+
pour deux ions fluorure F–.
-
La
formule statistique est la suivante : CaF2,
-
Le nom :
Le fluorure de calcium.
-
Dans
l’écriture de la formule d’un solide ionique, les charges ne figurent pas.
-
Par
convention, on choisit les plus petits indices qui assurent l’électroneutralité
du cristal.
-
La
formule statistique indique la nature et la proportion des ions présents dans le
cristal sans mentionner les charges.
2)- Cohésion d’un solide
moléculaire.
a)-
Le solide moléculaire.
-
Un
cristal moléculaire est un assemblage compact et ordonnée de molécules
électriquement neutre.
-
La
cohésion des solides moléculaires est assurée par deux types d’interactions
moléculaires :
-
L’interaction de Van Der Waals, qui est toujours présente
-
Les
liaisons hydrogène lorsqu’elles existent.
-
La
cohésion des solides moléculaires est nettement moins forte que la cohésion des
solides ioniques.
-
L’interaction de Van Der Waals est moins forte que l’interaction
électrostatique.
-
Les
liaisons hydrogène sont plus fortes que les interactions de Van Der Waals.
-
Il suffit
de comparer les températures de fusion de solides ioniques et de solides
moléculaires pour mettre en évidence cette différence.
-
La
température de fusion de l’eau est égale à 0 ° C alors que la température de
fusion du chlorure de sodium est égale à 801 ° C.
b)-
Interactions de Van Der Walls.
-
L’interaction de Van Der Waals résulte de l’interaction électrostatique
attractive qui existe entre les molécules.
►
Cas de molécules polaires :
-
Dans ces
molécules, il y a des interactions électrostatiques entre les
charges partielles permanentes
portées par les atomes.
-
Ce sont
ces interactions entre les charges partielles permanentes qui assurent la
cohésion du solide moléculaire.
-
C’est le
cas du chlorure d’iode
-
Le
chlorure d'iode I – Cℓ se présente, à température ambiante, sous la forme
d'un liquide rouge très foncé. Sa température de fusion est 13,9 ° C.

-
Le chlore
est plus électronégatif que l’iode (le chlore est situé 2 cases au-dessus de
l’iode dans la classification périodique).

-
Dans le
cristal moléculaire, les molécules s’oriente de telle manière que l’atome d’iode
(pôle +) soit toujours voisin d’un atome de chlore (pôle –).
-
Schéma :
►
Cas de molécules apolaires :
-
On peut
prendre comme exemple de cristal moléculaire, le diiode qui est constitué d’un
empilement compact et ordonnée de molécules de diiode
I – I.
-
La
molécule de diiode est apolaire car elle est constituée de deux atomes
identiques.
-
Mais les
électrons n’ont pas de position définie.
-
Ils ont
une probabilité de présence dans le nuage électronique qui entoure les noyaux.
-
Les
électrons se déplacent à grande vitesse et ont un mouvement permanent.
-
À un
instant donné, il se peut que les électrons soient plus proches d’un des noyaux.
-
Il
apparaît alors des charges partielles positives et négatives instantanées au
sein de la molécule.
-
Ces
charges partielles instantanées engendre d’autres charges partielles
instantanées et ceci de proche en proche.

t’ = t + Δt

-
C’est
l’interaction électrique entre ces charges partielles positives et négatives
instantanées qui assurent la cohésion du cristal moléculaire constitué de
molécules apolaires.
|
-
La
cohésion d’un cristal moléculaire est assurée |
c)-
Les liaisons hydrogènes.
-
Une
liaison hydrogène se forme lorsqu’un atome d’hydrogène
H, qui est lié à
un atome A très électronégatif, interagit avec un atome
B,
également très électronégatif et porteur d’un ou plusieurs doublets non liants.
-
Les
atomes A et
B qui interviennent généralement sont :
-
L’azote
N, l’oxygène
O, le fluor
F et le chlore
Cℓ.
-
Les trois
atomes qui participent à la liaison hydrogène sont généralement alignés.
-
Représentation de la liaison hydrogène :
-
Exemple :
Une liaison hydrogène peut s’établir entre un atome d’hydrogène d’une molécule
d’eau et un atome d’oxygène appartenant à une autre molécule d’eau.
-
Les
molécules qui possèdent le groupe – O – H forment des liaisons
hydrogènes.
-
C’est le
cas des alcools à l’état condensé comme l’éthanol, de l’eau dans la glace.
-
Ces
liaisons hydrogènes participent à la cohésion du cristal.
-
Dans ce
cas, la cohésion du cristal est due aux liaisons hydrogène et aux interactions
de Van Der Waals.
II- La solubilité d’une
espèce chimique.
a)-
Solvant polaire.
-
Un
solvant constitué de molécules polaires est un solvant polaire.
-
Exemple :
-
L’eau
H2O :
solvant polaire.
-
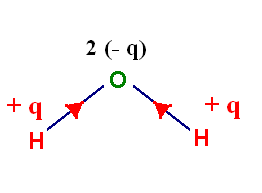
L’oxygène
est plus électronégatif que l’hydrogène :
χ (O) = 3,44 et
χ
(H) = 2,2
-
Les deux
liaisons covalentes O – H d’une molécule d’eau sont polarisées.
-
Représentation :

-
La
molécule étant coudée, les position moyennes des charges partielles positives et
négatives ne sont pas confondues : la molécule d’eau est polaire.
-
L’eau
molécule polaire est un solvant polaire.
-
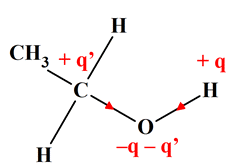
L’éthanol CH3
–
CH2
– OH: solvant polaire.
-
L’oxygène
est plus électronégatif que l’hydrogène et que le carbone :
-
Alors que
les électronégativités du carbone et de l’hydrogène sont proches
-
χ
(O) = 3,44 ;
χ (C) = 2,55 et
χ (H) = 2,2
-
Du fait
de la présence du groupe – O – H,
l’éthanol est une molécule
polaire.
-
Les
liaisons C –
H, sont peu polarisées.
b)-
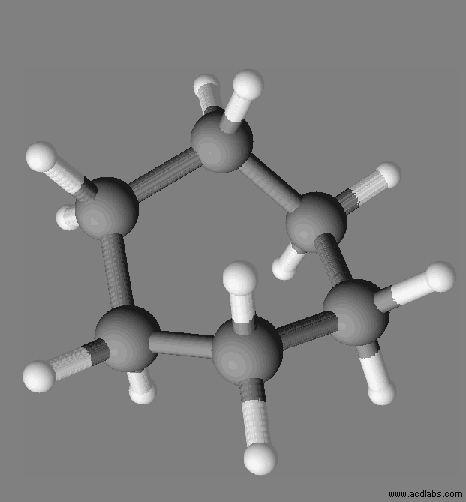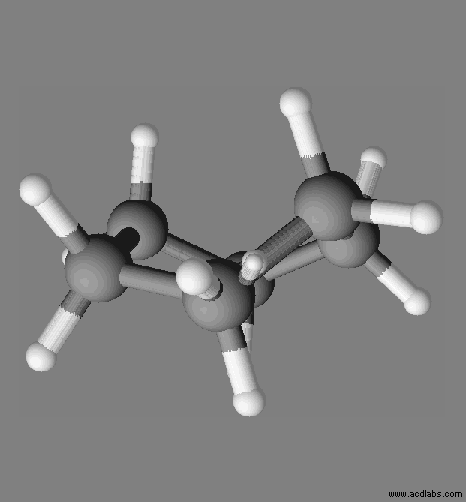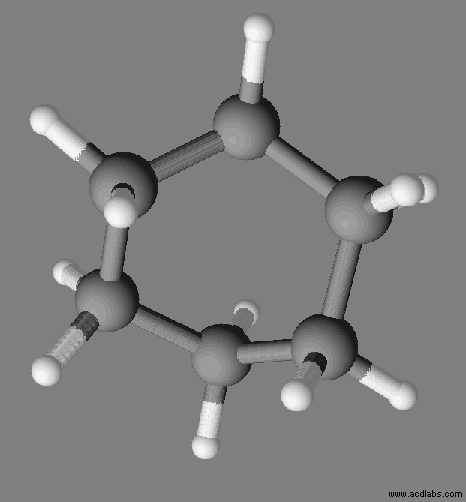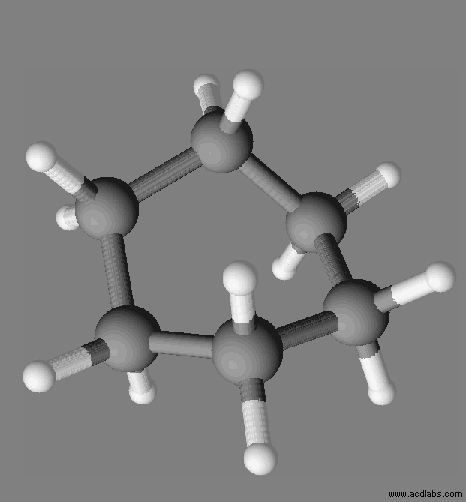
Solvant apolaire.
-
Un
solvant constitué de molécules apolaires est un solvant apolaire.
-
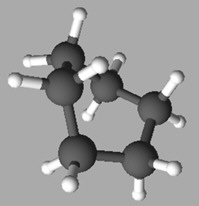
Exemple :
le cyclohexane C6H12.
-
Les
électronégativités du carbone et de l’hydrogène sont proches :
-
χ
(C) = 2,55 et
χ (H) = 2,2
-
Les
liaisons C
– H,
sont peu polarisées.
-
La
molécule de cyclohexane est apolaire, c’est un solvant apolaire.
2)- Solubilité d’un soluté
dans un solvant.
a)-
Généralités.
-
Un soluté
est soluble dans un solvant si les interactions entre les entités du soluté sont
du même type que celles qui s’exercent entre les molécules du solvant.
-
Les
solides ioniques sont solubles dans les solvants polaires.
-
Un soluté
moléculaire polaire est généralement soluble dans un solvant polaire.
-
Un soluté
moléculaire apolaire est soluble dans un solvant apolaire.
b)-
Dissolution d’un soluté moléculaire polaire dans un
solvant polaire.
►
Exemple : Le soluté est la propanone et le
solvant l’acétone.
-
Il n’y a pas de liaison hydrogène.
![]() On verse
quelques gouttes de butanone dans de la propanone (acétone : solvant
industriel).
On verse
quelques gouttes de butanone dans de la propanone (acétone : solvant
industriel).
-
On agite.
-
On
obtient une solution homogène.
-
Le soluté
est la propanone et le solvant l’acétone.
-
La
butanone, soluté polaire et soluble dans un solvant polaire la propanone.
|
Molécule de propanone |
Molécule de
butanone |
|
|
|
-
La
solubilité est liée au fait que des interactions de Van Der Waals s’établissent
entre les molécules polaires de soluté et les molécules polaires de solvant.
|
|

Molécule de propanone parmi des molécules
d’acétone.
►
Exemple : Le soluté est le saccharose et le
solvant l’eau.
-
Il y a
des liaisons hydrogène.
![]() Exemple
1 : On verse de l’eau sur un morceau de sucre placé dans un bécher.
Exemple
1 : On verse de l’eau sur un morceau de sucre placé dans un bécher.
Le sucre est
du saccharose de formule C12H22O11
(s).
-
On agite.
On obtient une solution homogène.
-
C’est de
l’eau sucrée : solution aqueuse de saccharose.
-
Cette
solution ne conduit pas le courant électrique.
-
Cette
solution est constituée de molécules de saccharose parmi des molécules d’eau.
-
La
molécule de saccharose est une molécule polaire du fait de la présence de
plusieurs liaisons polarisées C – O et
O – H.

-
La
molécule d’eau est une molécule polaire du fait de la présence de deux liaisons
polarisées O – H.
-
La grande
solubilité du saccharose dans l’eau résulte :
-
Des
interactions de Van Der Waals qui interviennent entre les molécules de soluté
(le saccharose) et les molécules de solvants (eau) ;
-
Et la
formation de nombreuses liaisons hydrogène qui s’établissent entre les molécules
de soluté (le saccharose) et les molécules de solvants (eau).
3)- Dissolution d’un soluté
apolaire dans un solvant apolaire.
![]() Expérience 1 : Diiode dans l’eau :
Expérience 1 : Diiode dans l’eau :
-
La
molécule de diiode est une molécule apolaire.
-
On verse
quelques cristaux de diiode dans un tube à essais contenant de l’eau (solvant
polaire).
-
On agite.
La solution prend une teinte jaune-orangé et il reste du diiode solide au fond
du tube à essais.

-
Le diiode
soluté apolaire est peu soluble dans l’eau, solvant polaire.
![]() Expérience 2 : Diiode dans l’heptane.
Expérience 2 : Diiode dans l’heptane.
-
On
rajoute environ 3 mL d’heptane (incolore), solvant apolaire, dans le tube à
essais.
-
L’heptane
est non miscible dans l’eau et moins dense que l’eau.
-
On le
verse délicatement, l’heptane se situe au-dessus de la phase aqueuse.
-
On agite
et on laisse décanter.

-
On
remarque que l’heptane initialement incolore prend une teinte fuchsia et la
solution aqueuse s’éclaircie.
-
Le diiode
au fond du tube à essais à disparu.
-
Le
diiode, soluté apolaire, est soluble dans le solvant apolaire alors qu’il est
très peu soluble dans un solvant polaire.
|
sont généralement solubles dans les solvants apolaires. |
4)- Dissolution d’un solide
ionique dans l’eau.
a)-
Mise en évidence :
![]() Exemple 2 :
dissolution du chlorure de sodium dans l’eau.
Exemple 2 :
dissolution du chlorure de sodium dans l’eau.
-
D’une
part le chlorure de sodium est un solide ionique.
-
C’est un
empilement compact et ordonné d’ion sodium et d’ions chlorure.
-
D’autre
part, l’eau est un solvant polaire.
-
La
dissolution du cristal se fait en plusieurs étapes :
►
Première étape : Dissociation du solide ionique.
-
Les ions
sodium sont attirés par les pôles négatifs des molécules d’eau et les ions
chlorure sont attirés par les pôles positifs des molécules d’eau.
-
Ce
phénomène entraîne la diminution des interactions entre les cations et les
anions du cristal.
-
Les ions
sodium et chlorure se dissocient du cristal ionique.
►
Deuxième étape : Hydratation des ions.
-
Les ions
sodium Na+ et les ions chlorure
Cℓ–
s’entourent d’un cortège de molécules d’eau.
-
Ils sont
hydratés.
►
Troisième étape : La dispersion des ions.
-
Les ions
hydratés se déplacent dans le solvant et s’éloignent sous l’effet de l’agitation
thermique.
-
Ils se
dispersent dans l’eau avec leur cortège respectif de molécules d’eau.
-
Ce
cortège masque en partie la charge portée par les ions et empêche l’agrégation
des ions.
|
-
La dissociation des ions du
solide ;
-
La solvatation des ions ;
-
La dispersion des ions dans le
solvant.
-
Les ions s’entourent dans ce
cas de molécules de solvant.
-
On dit qu’ils sont solvatés. |
b)-
Équation de la réaction de dissolution.
►
Exemple : Cas de la dissolution du chlorure de
sodium dans l’eau.
-
La
formule du cristal : NaCℓ (s)
-
Formule
des ions hydratés : on utilise la notation simplifiée suivante :
-
Na+ (aq) et
Cℓ–
(aq)
-
On ne
précise pas le nombre de molécules d’eau qui entoure chaque ion.
-
Équation
de dissolution :
|
|
eau |
|
|
|
|
NaCℓ
(s) |
→ |
Na+
(aq) |
+ |
Cℓ–
(aq) |
|
L’équation de dissolution doit respecter la conservation des éléments chimiques
et la conservation de la charge. |
► Application 1 : On dissout de la fluorine (fluorure de calcium CaF2) dans l’eau.
- Écrire l’équation de dissolution. Formule de l’ion fluorure :
F–.
-
Réponse :
|
|
eau |
|
|
|
|
CaF2
(s) |
→ |
Ca2+
(aq) |
+ |
2
F–
(aq) |
|
- La dissolution d’un solide ionique dans l’eau est modélisée par une équation de réaction de dissolution qui doit respecter
la conservation des éléments
chimiques et de la charge électrique. |
-
Pour un
solide ionique de formule MnXp (s) constitué des ions
Mp+ et
Xn–, cette équation s’écrit :
|
|
eau |
|
|
|
|
MnXp
(s) |
→ |
n
Mp+
(aq) |
+ |
p
Xn–
(aq) |
c)-
Concentration en quantité de matière d’un ion.
-
Pour un
solide ionique de formule MnXp (s) constitué des ions
Mp+ et
Xn–, cette équation s’écrit :
|
|
eau |
|
|
|
|
MnXp
(s) |
→ |
n
Mp+
(aq) |
+ |
p
Xn–
(aq) |
-
La
concentration en quantité de matière des ions Mp+
et Xn–, dans la solution est notée
-
[Mp+] ou [Xn–].
-
Elle est
donnée par la relation :
|
|
-
[Mp+]
concentration en soluté apporté en mol / L
-
n
(Mp+)
quantité de matière de soluté apporté en mol
-
V
volume de la solution aqueuse obtenue en L. |
-
Ou :
|
|
-
[Xn–]
concentration en soluté apporté en mol /
L
- n
(Xn–)
quantité de matière de soluté apporté en mol
-
V
volume de la solution aqueuse obtenue en L. |
►
Application 2 :
-
On
prépare une solution aqueuse de sulfate de sodium
Na2SO4
(s).
-
Pour ce
faire, on dissout une masse m =
-
Le volume
de la solution obtenue est V =
-
Déterminer la concentration en soluté apporté de cette solution.
-
En
déduire la concentration des ions présents dans la solution
-
Données :
M
(Na) = 23,0 g . mol–1 ;
M
(S) = 32,1 g . mol–1 ;
M
(O) = 16,0 g . mol–1
►
Réponses :
-
On peut
dans un premier temps, déterminer la quantité de matière initiale
n0 en soluté
apporté :
-
Masse
molaire M
du sulfate de sodium Na2SO4 (s) :
-
M
= 2 M
(Na) +
M (S) + 4
M
(O)
-
M
= 2 × 23,0 + 32,1 + 4 × 16,0
-
M
≈ 142 g . mol–1
-
Quantité
de matière initiale n0 en soluté apporté :
-
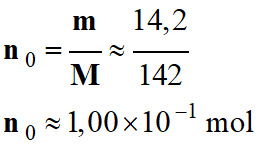
-
Concentration
en quantité de matière
C de la solution de sulfate de sodium :
-
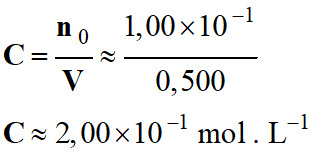
-
Pour la
suite de l’exercice, il faut s’aider d’un tableau d’avancement.
-
Tableau
d’avancement :
|
Équation bilan |
|
eau |
|
|
|
|
|
Na2SO4
(s) |
→ |
2
Na+ (aq) |
+ |
SO42–
(aq) |
||
|
État du
système |
Avancement |
n (Na2SO4) |
|
n (Na+) |
|
n (SO42–) |
|
État initial |
x =
0 |
n0
≈ |
|
0 |
|
0 |
|
État final |
x = xmax |
n0
– xmax =
0 |
|
2
xmax = 2
n0 |
|
xmax = n0 |
-
Concentration des ions sulfate.
-
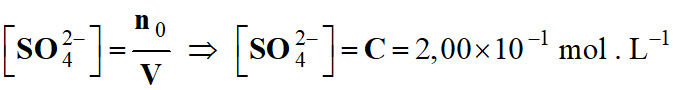
-
Concentration des ions sodium :
-
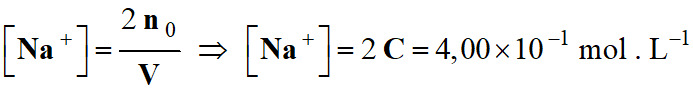
-
Remarque
1 :
-
La
concentration effective d’un ion dans la solution peut être différente de la
concentration en soluté apporté.
-
Remarque
2 :
-
L’écriture [Na2SO4] n’a pas de sens car
l’espèce Na2SO4 n’existe pas en solution.
-
La
formule Na2SO4
est une formule statistique
d’un cristal ionique.
-
Elle
indique que le cristal est formé d’ions sodium et d’ions sulfate et qu’il y a 2
ions sodium pour un ion sulfate.
5)- Le savon : un solide
ionique particulier.
a)-
Le savon.
-
Un savon
est un mélange de carboxylate de sodium ou de potassium.
-
On peut
donner la formule générale suivante :
-
(R–COO– +
Na+) ou (R–COO– +
K+)
-
Dans les
savons, on trouve l’ion carboxylate du type R–COO–,
-
R est une chaîne carbonée non ramifiée constituée de plus de 10 atomes de
carbone
-
et –COO– le groupe carboxylate.
-
Le groupe
carboxylate est
hydrophile (il s’entoure de
molécules d’eau polaire),
-
il est
lipophobe
car il n’a pas d’affinité pour les chaînes carbonées présentes dans les
graisses.
-
La chaîne
carbonée R est
hydrophobe
car elle n’est pas polaire,
-
Mais elle
est lipophile
car elle a beaucoup d’affinité pour les chaînes carbonées.
-
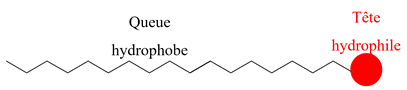
Les ions carboxylates
possèdent :
-
une extrémité
hydrophile – COO– tête hydrophile
-
une extrémité
lipophile R –
queue hydrophobe
-
Ce sont des espèces
amphiphiles.
-
Ce
sont des tensioactifs.
-
Représentation :
b)-
Exemple :
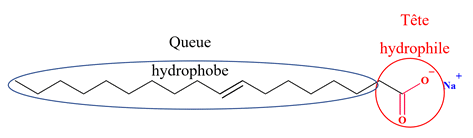
- Oléate de sodium :
CH3
– (CH2)7
– CH
= CH
– (CH2)7
– COONa
- Autres
formulations :
-
C17H33 –
COONa
ou (C17H33 –
COO–
+ Na+)
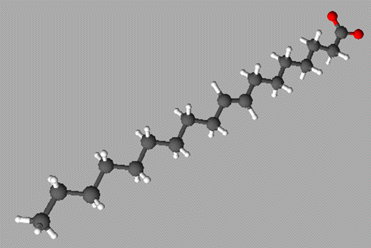
-
Molécule
3D :

-
L’oléate
de sodium a une chaîne carbonée R
contenant 17 atomes de carbone.
-
On le
trouve dans les savons fabriqués à partir de l’huile d’olive qui contient de
l’oléine.
c)-
Solubilité d’un savon.
-
Les
savons sont peu solubles dans l'eau.
-
Équation
de la réaction de dissolution d’un savon dans l’eau :
|
|
eau |
|
|
|
|
R – COONa
(s) |
|
R
– COO–
(aq) |
+ |
Na+
(aq) |
-
En
présence d’alcool, la solubilité augmente.
-
Le groupe
carboxylate – COO–
est chargé négativement ; il s’entoure très facilement de molécules d’eau
polaires.
d)-
Mode d'action des savons.
|
Mode d'action d'un savon :
-
Dans
l’eau les particules de savon se regroupent sous forme de micelles.
-
Les
parties hydrophobes (R chaîne carbonée non ramifiée) qui fuient l’eau se
rassemblent entre elles.
-
Elles
sont solubilisées grâce à l’affinité pour l’eau des extrémités hydrophiles (le
groupe carboxylate).
-
Les
parties hydrophobes sont solubles dans les huiles et les graisses constituant la
saleté du linge.
-
Ainsi les
particules savonneuses peuvent s’enfoncer dans les tâches organiques et les
retirer du tissu.
-
Les
gouttelettes d’huile se retrouvent enfermées dans un film polaire soluble dans
l’eau.
-
Les
micelles chargées négativement vont se repousser et se retrouver dispersées et
forment une émulsion.
-
Le savon
donne naissance à une mousse qui entraîne les particules mouillées.
-
En
s’interposant entre le tissu et la saleté, en détruisant son adhérence, un savon
abaisse les tensions superficielles.
-
C'est un
agent tensioactif.
-
Les
savons ont de ce fait des propriétés :
-
Mouillantes
-
Émulsifiantes
-
Moussantes.
-
Ce sont
de bons détergents. |
III- Extraction par un
solvant d’une espèce chimique en solution.
-
Une
extraction consiste à extraire, c’est-à-dire à prélever, une ou plusieurs
espèces chimiques d’un mélange.
-
L’extraction d’espèces chimiques à l’aide d’un solvant s’appuie sur les notions
de densité, de solubilité et de
miscibilité
2)- Extraction
liquide-liquide.
-
Lors
d’une extraction liquide / liquide :
-
L’espèce
chimique à extraire est plus soluble dans le solvant extracteur que dans le
solvant de départ.
-
Et le
solvant extracteur et le solvant de départ sont non miscibles.
|
un solvant S1 est extraite par un autre
solvant S2, appelé solvant d’extraction.
-
Le solvant
S2
est choisi tel que :
-
L’espèce chimique à extraire
est plus soluble dans le solvant
S2
que dans le solvant S1 ;
-
Le solvant
S2
est non miscible au solvant S1 ;
-
Le solvant
S2
présente un danger minimal pour la santé et l’environnement. |
►
L’extraction par un solvant se réalise dans une
ampoule à décanter.
-
Le choix
du solvant dépend de l’espèce chimique recherchée.
![]() Expérience 3:
extraction du diiode présent dans
une solution aqueuse.
Expérience 3:
extraction du diiode présent dans
une solution aqueuse.

![]() Protocole expérimental :
Protocole expérimental :
- Introduire le mélange (solution aqueuse d’iodure
de potassium et de diiode) dans l’ampoule à décanter
-
Puis ajouter délicatement le solvant (hexane ou
pentane : solvant organique : liquide incolore moins dense que la solution
aqueuse et non miscible)
-
L’heptane est un solvant apolaire, alors que
l’eau est un solvant polaire.
-
Le diiode est une molécule apolaire.
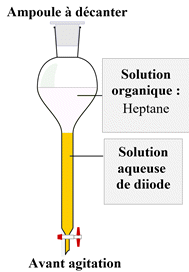
-
Agiter, laisser décanter et dégazer.
-
On observe alors
deux phases :
-
Une phase
aqueuse et une
phase organique.
-
La phase inférieure qui est pratiquement
décolorée (phase aqueuse)
-
et la phase supérieure (phase organique) qui
contient le diiode dans le solvant qui est violette.
-
La phase de plus faible densité surnage :
-
Dans le cas présent :
-
Densité de l’heptane :
d (heptane) = 0,68 et densité
de l’eau : d (eau) = 1,00.
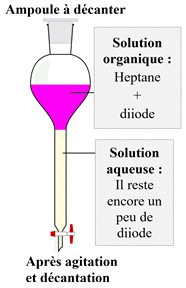
-
On dit que le diiode a été extrait par le
solvant.
-
On récupère la phase organique contenant le
diiode et le solvant.
-
Après évaporation du solvant, on recueille le
diiode (solide).
1)- Cohésion des molécules
d’eau dans la glace.
-
La glace est un cristal moléculaire.
-
C’est un assemble compact et ordonnée de
molécules polaires.
-
La cohésion du cristal est assurée par deux types
d’interactions moléculaires :
-
L’interaction de Van Der Waals ;
-
Les liaisons hydrogène.
-
La cohésion des solides moléculaires est
nettement moins forte que la cohésion de solides ioniques.
-
Structure de la molécule d’eau à l’état solide :
-
Représentation dans un cube :
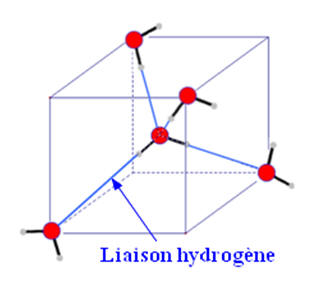
-
Représentation dans un tétraèdre :
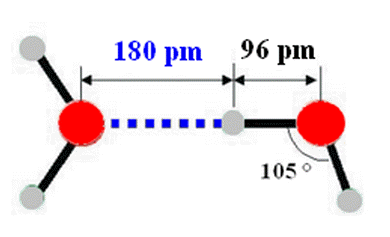
-
Dans la glace comme dans l’eau à l’état liquide,
toutes les molécules d’eau sont reliées entre elles par des liaisons hydrogène.
-
Chaque molécule d’eau est en relation avec 4
molécules voisines.
-
Dans la glace, les molécules d’eau ne peuvent pas
changer de position.
-
L’agitation thermique est réduite au maximum.
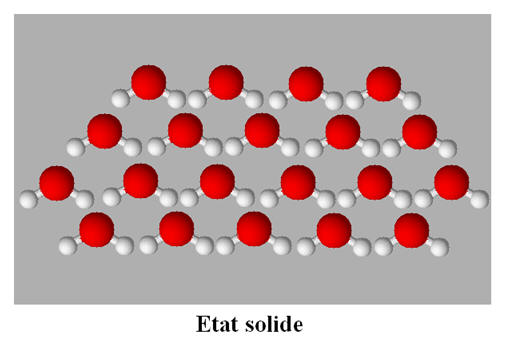
-
Dans l’eau à l’état liquide, l’agitation
thermique est plus importante.
-
Elle permet aux liaisons hydrogène de se
« tordre » et donne une liberté de mouvement.
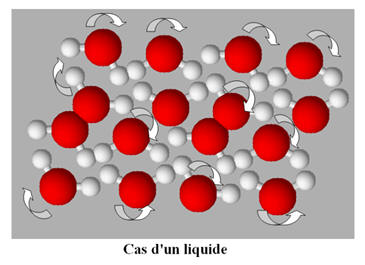
-
À l’état solide, les molécules d’eau forment un
ensemble structuré où chaque molécule se trouve en moyenne plus éloignée de ses
voisines que dans l’état liquide.
-
C’est pour cela que la densité de la glace (dglace
= 0,917) est plus faible que la densité de l’eau à l’état liquide.
2)- Préparation d’une
solution ionique.
a)-
But :
-
Pour préparer une solution ionique de
concentration donnée en ions, il faut déterminer la valeur de la masse
m de solide à dissoudre.
-
Quelle relation existe-t-il entre les
concentrations en quantité de matière des ions et la masse de solide dissout ?
b)-
Un engrais : le sulfate de potassium
K2SO4.
-
La composition d’un engrais est donnée par sa
formule, c’est-à-dire par trois nombre x,
y et
z représentatifs des teneurs respectives en azote
N, phosphore
P et potassium
K.
-
Le nombre
x est le pourcentage massique de l’engrais en azote
N.
-
Les pourcentages massiques de
P et
K s’en déduisent à partir des relations du tableau ci-dessous.
|
Formule de
l’engrais |
x |
y |
z |
|
Élément
chimique |
N |
P |
K |
|
Composition |
x
% |
0,43 × y % |
0,83 × z % |
-
Données :
-
Formule du sulfate de potassium :
K2SO4 (s)
-
Masse molaire :
M (K) = 39,1 g . mol–1 ;
M (S) = 32,1 g . mol–1 ;
M (O) = 16,0 g . mol–1
►
Questions :
|
1.
Écrire l’équation de dissolution du sulfate de potassium
dans l’eau. 2. Construire un tableau d’avancement associé à la réaction de dissolution du sulfate de potassium. On note
n0 (K2SO4) la quantité de solide dissous. 3. Exprimer les concentrations en quantité de matière des ions potassium [K+] et sulfate [SO42–], en fonction de xmax
et du volume Vsolution de la solution, puis en fonction de
n0 (K2SO4) et
Vsolution. 4. Un jardinier apporte du potassium à ses plantes en utilisant un engrais liquide 2-2-1 de densité d = 1,20. Ayant épuisé son stock, il décide de préparer une solution à partir de sulfate de potassium K2SO4 (s). Déterminer la masse de sulfate de potassium à peser pour préparer 1,00 L de solution de sulfate de potassium
contenant autant de potassium qu’un litre
d’engrais liquide 2-2-1. 5.
Pour ce solide ionique quelle relation existe-t-il entre
[K+] et [SO42–] ? 6. Pour un solide ionique de formule MnXp, quelles relations existe-t-il entre les concentrations en quantité de matière [Mp+]
et [Xn–] et ses ions et la masse
m0 de
solide dissous ? |
►
Réponses :
1.
Équation de dissolution du sulfate de potassium dans
l’eau :
|
|
eau |
|
|
|
|
K2SO4
(s) |
→ |
2
K+ (aq) |
+ |
SO42–
(aq) |
2.
Tableau d’avancement :
|
Équation bilan |
|
eau |
|
|
|
|
|
K2SO4
(s) |
→ |
2
K+ (aq) |
+ |
SO42–
(aq) |
||
|
État du
système |
Avanc. |
n (K
2SO4) |
|
n (K
+) |
|
n (SO42–) |
|
État
initial |
x =
0 |
n0
(K
2SO4) ≈ |
|
0 |
|
0 |
|
État
final |
x = xmax |
n0
(K
2SO4) – xmax =
0 |
|
2
xmax = 2
n0
(K
2SO4) |
|
xmax = n0
(K
2SO4) |
3.
Concentrations en quantité de matière :
-
Concentration en quantité de matière des ions
potassium [K+] :
-
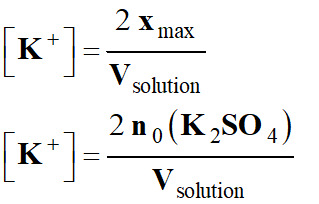
-
Concentration en quantité de matière des
ions sulfate [SO42–] :
-
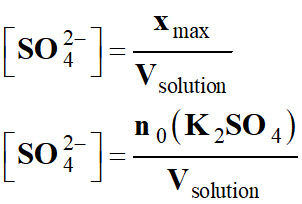
4.
Masse de sulfate de potassium à peser pour préparer 1,00
L de solution de sulfate de potassium contenant autant de potassium qu’un litre
d’engrais liquide 2-2-1.
-
Pourcentage massique
K en potassium de l’engrais :
-
0,83 ×
z
% = 0,83 %
-
Masse volumique de l’eau :
ρeau = 1,00 kg . L–1
-
La densité d’engrais :
d = 1,20
-
Masse d’un litre d’engrais :
-
m
(engrais) = d .
ρeau .
V
-
Masse de potassium
m (K) dans un litre
d’engrais :
-
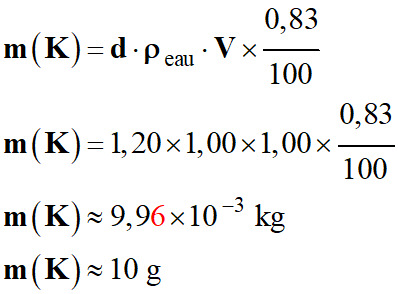
-
Le potassium se retrouve sous forme d’ions
potassium.
-
Quantité de matière de potassium
n (K+)
correspondante :
-
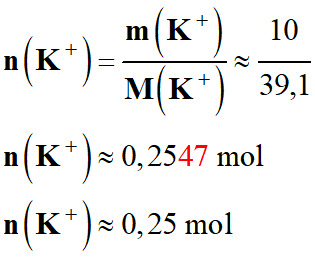
-
Du tableau d’avancement de la réaction de
dissolution, on tire la relation suivante :
-
n (K +) =
2 xmax =
2
n0
(K 2SO4)
-
Quantité de matière
n0 (K 2SO4)
de solide à dissoudre :
-
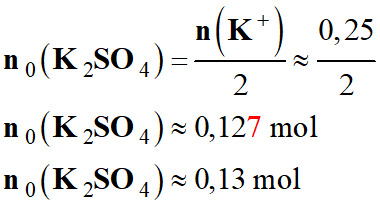
-
Masse de sulfate de potassium à peser :
-
m0 (K
2SO4) =
n0 (K 2SO4)
. M (K 2SO4)
-
m0 (K
2SO4) = 0,13 ×
(2 × 39,1 + 32,1 + 4 ×16,0)
-
m0 (K
2SO4) ≈ 22,1998
g
-
m0 (K
2SO4) ≈ 22 g
5.
Relation entre [K+] et [SO42–] :
- 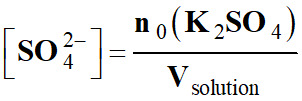 et
et 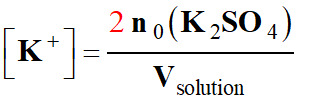
-
[K+]
= 2 [SO42–]
-
Tableau :
|
Équation bilan |
|
eau |
|
|
|
|
K2SO4
(s) |
→ |
2
K+ (aq) |
+ |
SO42–
(aq) |
|
|
Quantité de matière |
|
n (K
+) |
|
n (SO42–) |
|
|
Coefficient stœchiométrique |
2 |
1 |
|||
|
Relation
|
|
||||
6.
Relation entre les concentrations en quantité de matière
[Mp+] et [Xn–] :
-
Tableau d’avancement :
|
Équation bilan |
|
eau |
|
|
|
|
|
MnXp
(s) |
→ |
n Mp+ (aq) |
+ |
p
Xn–
(aq) |
||
|
État du
système |
Avanc. |
n (MnXp) |
|
n (Mp+) |
|
n (Xn–) |
|
État
initial |
x =
0 |
n0
(MnXp) ≈ |
|
0 |
|
0 |
|
État
final |
x = xmax |
n0
(MnXp) – xmax = 0 |
|
n
xmax = n
n0
(MnXp) |
|
p
xmax =
p
n0 (MnXp) |
-
Quantité de matière initiale de solide dissous :
n0
(MnXp)
-
État final :
xmax =
n0
(MnXp)
-
Masse de solide dissous :
-
m0
(MnXp) =
n0
(MnXp) .
M (MnXp)
-
Volume de la
solution obtenue : Vsolution
-
Concentration des ions :
-
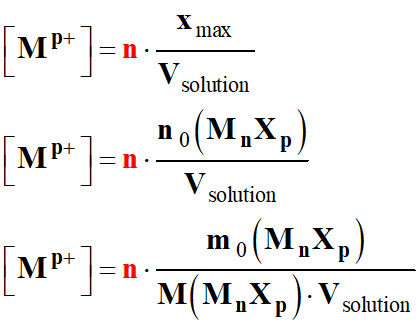
-
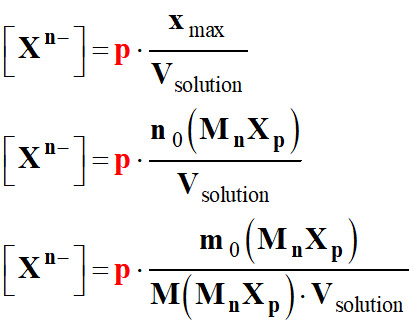
-
Relation entre les concentrations des ions :
|
Équation bilan |
|
eau |
|
|
|
|
MnXp
(s) |
→ |
n Mp+ (aq) |
+ |
p
Xn–
(aq) |
|
|
Quantité de matière |
|
n (Mp+) |
|
n (Xn–) |
|
|
Coefficient stœchiométrique |
n |
p |
|||
|
Relation p
. [Mp+] = n
. [Xn–] |
|
||||
-
p . [Mp+]
= n .
[Xn–]
►
Exemple : dissolution du sulfate d’aluminium (III) :
Aℓ2(SO4)3
(s)
-
Tableau d’avancement :
-
Quantité de matière initiale de sulfate
d’aluminium (III) :
n0
|
Équation
bilan |
|
eau |
|
|
|
|
|
Aℓ2(SO4)3
(s) |
→ |
3 Aℓ3+ (aq) |
+ |
2
SO42–
(aq) |
||
|
État du
système |
Avanc. |
n (Aℓ2(SO4)3) |
|
n (Aℓ3+) |
n (SO42–) |
|
|
État
initial |
x =
0 |
n0
|
|
0 |
|
0 |
|
État
final |
x = xmax |
n0
– xmax =
0 |
|
3
xmax = 3
n0
|
|
2
xmax =
2
n0
|
-
Relation entre les concentrations des ions :
|
Équation bilan |
|
eau |
|
|
|
|
Al2(SO4)3
(s) |
→ |
3 Aℓ3+ (aq) |
+ |
2
SO42–
(aq) |
|
|
Quantité de matière |
|
n (Aℓ3+) |
|
n (SO42–) |
|
|
Coefficient stœchiométrique |
3 |
2 |
|||
|
Relation p
. [Mp+] = n
. [Xn–] |
|
||||
-
2 . [Aℓ3+]
= 3 .
[SO42–]
|
La
cohésion d’un solide ionique ou moléculaire.
La
solubilité d’une espèce chimique.
L’extraction par un solvant d’une espèce en solution. |
|
1)-
Exercice 04 page 112 : Expliquer la cohésion d’un
solide. 2)-
Exercice 06 page 112 : Justifier une solubilité.
3)-
Exercice 07 page 112 : Prévoir une solubilité. 4)-
Exercice 08 page 113 : Écrire des équations de réaction
de dissolution. 5)- Exercice 12 page 113 : Calculer la concentration en quantité de matière d’un ion à partir de la masse d’un solide. 6)-
Exercice 13 page 113 : Calculer la masse d’un solide à
dissoudre. 7)-
Exercice 16 page 114 : Choisir un solvant d’extraction
adapté. 8)-
Exercice 21 page 115
: Solubilité de molécules organiques 9)-
Exercice 24 page 116 : Un traitement de la vigne. 10)-
Exercice 26 page 117 :DS (40 min) Traiter une carence en calcium. 11)-
Exercice 27 page 117 :
DS (20 min) Du soufre dans les
hydrocarbures. |