|
Cohésion de la matière |
|
|
|
|
|
|
QCM N° 06
La cohésion
d’un solide ionique ou moléculaire.
La solubilité
d’une espèce chimique.
L’extraction
par un solvant d’une espèce en solution.
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
L’interaction
entre l’ion
calcium Ca2+
et l’ion
chlorure Cℓ–
est : |
Attractive. |
Répulsive. |
Due à une
liaison de
Van Der Waals |
A |
|
2 |
La cohésion de
l’eau à l’état
solide
est
principalement
assurée par :
|
Des
interactions
attractives
entre
les molécules |
Des liaisons
de
Van Der Waals
entre les
molécules |
Des liaisons
hydrogène
entre les
molécules |
ABC |
|
3 |
Des liaisons
hydrogène
peuvent
exister entre les
molécules de
formule : |
CH4 |
H2O |
H2 |
B |
|
4 |
L’éthanol est
constitué
de molécules
polaires.
Il est :
|
Insoluble
dans l’eau |
Soluble dans
un solvant
polaire |
Peu soluble
dans un
solvant
apolaire |
BC |
|
5 |
L’hexane est
constitué
de molécules
apolaires.
Il est un bon
solvant pour : |
Un solide
ionique |
Un solide
moléculaire
polaire |
Un solide
moléculaire
apolaire |
C |
|
6 |
Lors de la
dissolution
d’un solide
ionique
dans l’eau,
les ions : |
Se dissocient |
Sont hydratés |
Se dispersent
dans la solution |
ABC |
|
7 |
L’équation de
la réaction
de dissolution
du solide
ionique, le
chlorure de
magnésium
MgCℓ2,
dans l’eau
peut s’écrire : |
MgCℓ2
(s) →
Mg2+
(aq)
+
Cℓ–
(aq) |
MgCℓ2
(s) →
Mg
(aq)
+
2 Cℓ–
(aq) |
MgCℓ2
(s) →
Mg2+
(aq)
+
2 Cℓ–
(aq) |
C |
|
8 |
L’équation de
la réaction
de dissolution
du nitrate
de fer (III)
est :
Fe(NO3)3
(s) →
Fe3+
(aq) + 3 NO3– (aq)
La solution
obtenue lors
de la
dissolution de
Fe(NO3)3
(s) dans
l’eau
contient : |
Autant d’ions
fer (III)
Fe3+
(aq)
que d’ions
nitrate
NO3–
(aq) |
Trois fois
plus d’ions
fer (III)
Fe3+
(aq)
que d’ions
nitrate
NO3–
(aq) |
Trois fois
plus d’ions
d’ions
nitrate
NO3–
(aq)
que d’ions
fer (III)
Fe3+
(aq) |
C |
|
9 |
L’ion de
formule
C12H25COO–
possède : |
Un groupe
carboxylate
– COO–
lipophile |
Un groupe
carboxylate
– COO–
hydrophile |
Un groupe
Alkyle
– C12H25
hydrophobe |
BC |
|
10 |
On veut
extraire une
espèce
chimique dissoute
dans un
solvants S1.
Le solvant
d’extraction
doit être :
|
Miscible
avec le
solvant S1 |
Non miscible
avec le
solvant S1 |
D’une densité
égale à celle
du solvant
S1 |
B |
|
11 |
Le
tétrachlorure de
carbone CCℓ4
a une
densité
d = 1,59. Il est
non miscible à
l’eau.
Le mélange de
ces
deux solvants
peut être : |
|
|
|
A |
|
12 |
L’éthanol a
une densité
d
= 0,79. Il est miscible
à l’eau. Le
mélange de
ces deux
solvants peut
être
schématisé par : |
|
|
|
C |
QCM réalisé avec le logiciel Questy
Le cristal ionique :
Cohésion d’un solide moléculaire :
Les liaisons hydrogènes.
Solvant polaire.
Solvant apolaire.
Dissolution d’un solide ionique dans l’eau :
Équation de la réaction de dissolution :
|
|
eau |
|
|
|
|
MnXp
(s) |
→ |
n
Mp+
(aq) |
+ |
p
Xn–
(aq) |
Concentration en quantité de matière d’un ion :
|
|
-
[Mp+]
concentration en soluté apporté en mol / L
- n
(Mp+)
quantité de matière de soluté apporté en mol
- V
volume de la solution aqueuse obtenue en L. |
|
|
- [Xn–]
concentration en soluté apporté en mol / L
- n
(Xn–)
quantité de matière de soluté apporté en mol
- V
volume de la solution aqueuse obtenue en L. |
Le savon :
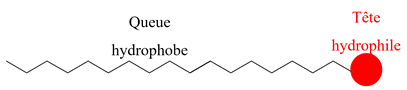
Solubilité d’un savon.
|
|
eau |
|
|
|
|
R
– COONa
(s) |
|
R
– COO–
(aq) |
+ |
Na+
(aq) |
Mode d'action des savons :
Extraction par un solvant d’une espèce chimique en
solution :
Extraction liquide-liquide :
Cohésion des molécules d’eau dans la glace.
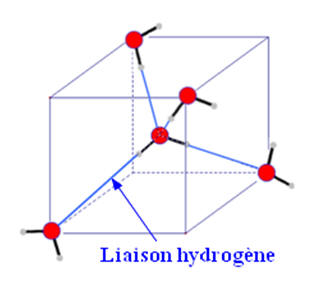
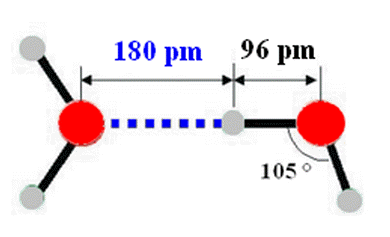
|
|