|
TP Chimie N° 13 |
Oxydation ménagée des alcools.
|
|
|
Programme 2011 : Physique et Chimie Programme 2020 : Physique et Chimie |
|
|
|
Matériel : |
Tubes à essais, béchers et erlenmeyers. |
|
|
Solutions : solution de permanganate de potassium C1 = 1,0 mol / L, Acide sulfurique C2 =
5,0 mol / L. Produits : Alcool primaire : propan-1-ol, densité
d1 = 0,803, Alcool secondaire : Propan-2-ol, densité
d2 = 0,786, Un solvant organique : l'hexane,
l'heptane ou autre. Réactifs : D.N.P.H et réactif de
schiff. |
|
|
M
g / mol |
densité |
θéb
°C |
Pictogrammes |
|
Propan-1-ol |
60,1 |
0,803 |
97,1 |
|
|
Propan–2–ol |
60,1 |
0,786 |
82,4 |
|
|
Propanal |
58,1 |
0,810 |
48,8 |
|
|
Acide propanoïque |
74,1 |
0,990 |
141,2 |
|
|
Propan–2–one |
58,0 |
1,05 |
56 |
|
|
Permanganate de potassium |
|
|
|
|
|
Acide sulfurique |
|
|
|
|
|
A - Oxydation ménagée d'un alcool primaire : le propan-1-ol I - L'oxydant est introduit par défaut. II - L'oxydant est introduit par excès. B - Oxydation ménagée d'un alcool secondaire. |
A-
Oxydation
ménagée d'un alcool primaire : le propan-1-ol.
I- L'oxydant est introduit par
défaut.
-
On veut oxyder l'alcool primaire en aldéhyde grâce à une
solution de permanganate de potassium en milieu acide et mettre en évidence
les produits de la réaction.
![]() Écrire l'équation bilan de la réaction.
Écrire l'équation bilan de la réaction.
-
Une oxydation ménagée est une oxydation qui s’effectue sans
rupture de la chaine carbonée.
-
La chaine carbonée est conservée.
-
Pour oxyder le propan-1-ol, on utilise une solution aqueuse
de permanganate de potassium en milieu acide.
|
MnO4–
+ 8
H+
+ 5 e– =
Mn2+
+ 4 H2O |
|
CH3─CH2─CH2─OH
= CH3─CH2─CHO
+
2 H+
+ 2 e– |
|
5 CH3─CH2─CH2─OH
+ 2 MnO4–
+ 6
H+ → 5
CH3─CH2─CHO + 2 Mn2+ + 8 H2O
|
![]() Calculer la quantité de matière
n0
d'alcool utilisée.
Calculer la quantité de matière
n0
d'alcool utilisée.
-
Quantité de matière
n0
d'alcool utilisée :
-
On utilise :
-
1,0 mL de propan-1-ol pur :
-
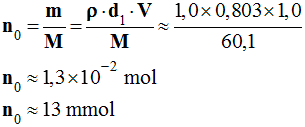
-
5,0 mL de solution de permanganate de potassium de
concentration C1 = 1,0 mol / L,
-
Quantité de matière
n1 ion permanganate
utilisé :
|
KMnO4 |
→ |
K+ (aq) |
+ |
MnO4–
(aq) |
|
n1 |
|
n1 |
|
n1 |
-
n1 =
C .
V ≈
1,0
×
5,0
×
10–3 mol
-
n1
≈ 5,0
×
10–3 mol
-
n1
≈ 5,0 mmol
-
3,0 mL de solution d’acide sulfurique de concentration
C2
= 5,0 mol / L
-
Quantité de matière
n2 d’ions
H+
(aq) utilisé :
|
H2SO4 |
→ |
2 H+
(aq) |
+ |
SO42–
(aq) |
|
n |
|
2n = n2 |
|
n |
-
n2 = 2
C .
V ≈ 2
×
5,0
×
3,0
×
10–3 mol
-
n2
≈ 30
×
10–3 mol
-
n2
≈ 30 mmol
![]() Dresser un tableau d’avancement de la réaction.
Dresser un tableau d’avancement de la réaction.
|
Équation |
5 CH3─CH2─CH2─OH |
+ 2 MnO4–
(aq) |
+
6
H+
(aq) |
→ |
5 CH3─CH2─CHO
(ℓ) |
+
2
Mn2+
(aq) |
+
8
H2O
(ℓ) |
|
|
mmol |
mmol |
mmol |
|
mmol |
mmol |
mmol |
|
État i |
n0
≈ 13 |
n1
≈ 5,0 |
n2
≈ 30 |
|
0 |
0 |
– |
|
État x |
n0
– 5x |
n1
– 2
x |
n2
– 6
x |
|
5
x |
2
x |
– |
|
État max |
n0
– 5xmax |
n1
– 2
xmax |
n2
– 6
xmax |
|
5
xmax |
2
xmax |
– |
-
Valeur
xmax de l’avancement
maximal :
-
Il est égal à la plus petite des 3 valeurs.
|
n0
– 5xmax0
= 0 |
n1
– 2
xmax1 = 0 |
n2
– 6
xmax2 = 0 |
|
|
|
|
-
En conséquence,
xmax =
xmax1
≈ 2,5 mmol
-
Le réactif limitant est bien l’ion
permanganate.
-
La coloration violette due aux ions
permanganate disparaît.
|
Équation |
5 CH3─CH2─CH2─OH |
+ 2 MnO4–
(aq) |
+
6
H+
(aq) |
→ |
5 CH3─CH2─CHO
(ℓ) |
+
2
Mn2+
(aq) |
+
8
H2O
(ℓ) |
|
|
mmol |
mmol |
mmol |
|
mmol |
mmol |
mmol |
|
État i |
n0
≈ 13 |
n1
≈ 5,0 |
n2
≈ 30 |
|
0 |
0 |
– |
|
État x |
n0
– 5x |
n1
– 2
x |
n2
– 6
x |
|
5
x |
2
x |
– |
|
État final |
0,50 |
0 |
15 |
|
12,5 |
5,0 |
– |
2)- Protocole expérimental :
a)- Expérience 1 : Réaction d'oxydation
![]() Prendre un tube à essais
T1.
Verser 1,0 mL de propan-1-ol.
Prendre un tube à essais
T1.
Verser 1,0 mL de propan-1-ol.
-
Ajouter
5,0 mL de solution de permanganate de
potassium.
-
Puis ajouter délicatement et lentement
3,0 mL d'acide
sulfurique (attention aux projections)
-
Pourquoi doit-on toujours prendre des précautions avec l'acide
sulfurique ?
-
L’acide
sulfurique provoque un échauffement du mélange réactionnel.
-
Il faut verser
l’acide concentré très lentement pour éviter l’ébullition et les
projections.
-
On peut rajouter un peu d'eau distillée pour refroidir.
-
Boucher, agiter et laisser reposer.
b)-
Expérience 2 : Extraction des
produits organiques de la phase aqueuse
![]() Dans le tube à essais
T1, verser
2
à 3 mL d'hexane.
Dans le tube à essais
T1, verser
2
à 3 mL d'hexane.
-
Boucher, agiter et laisser reposer.
c)-
Expérience 3 : Tests
d'identification
![]() Prendre le tube à essais
T1,
Prendre le tube à essais
T1,
-
Verser par moitié la phase organique qui surnage dans deux
tubes à essais T2 et
T3.
-
Faire le test à la D.N.P.H dans le tube
T2
-
Faire le test au réactif de
schiff dans le tube
T3.
![]() Faire les schémas des différentes étapes du protocole
expérimental en indiquant les observations, le nom des réactifs et des
produits.
Faire les schémas des différentes étapes du protocole
expérimental en indiquant les observations, le nom des réactifs et des
produits.
- Étape 1 :
- Dans un tube à essai
T1
contenant du propan-1-ol, on ajoute une solution de permanganate de
potassium, puis la solution d’acide sulfurique concentré.
- La coloration violette due aux ions
permanganate disparaît progressivement.
- En fin d’ajout, la solution est incolore.
Tous les ions permanganate ont disparu.
- Schémas :
-
Étape 2 :
-
On ajoute environ 3 mL d’hexane (solvant organique), on
bouche et on agite.
-
On laisse reposer le mélange réactionnel.
-
Il apparaît deux phases. Une phase organique située
au-dessus et une phase aqueuse.
-
On prélève un peu de la phase organique que l’on verse
dans deux tubes à essais T2 et
T3.
-
Le test à la D.N.P.H est positif dans le tube
T2
-
Le test au réactif de
schiff est positif dans le
tube T3.
-
Schémas :
![]() Quel type de réaction a lieu dans le tube
T1
?
Quel type de réaction a lieu dans le tube
T1
?
-
Dans le tube
T1, il se
produit l’oxydation du propan-1-ol (alcool primaire).
-
Les ions permanganate MnO4–
(aq) (de coloration violette) ont été réduits en ions manganèse
Mn 2+ (aq) (incolore).
-
Demi-équation électronique :
-
MnO4–
(aq)+
8
H+
(aq)+
5 e–
=
Mn2+
(aq) + 4 H2O
(ℓ)
![]() Que concluez-vous d'après les résultats des tests effectués
dans T2
et T3
?
Que concluez-vous d'après les résultats des tests effectués
dans T2
et T3
?
-
Le test à la D.N.P.H est positif. Le produit obtenu est
un composé carbonylé (aldéhyde ou cétone)
- Le test au réactif de schiff est positif.
- Le produit obtenu est un aldéhyde : le
propanal.
-
Demi-équation électronique :
-
CH3─CH2─CH2─OH
= CH3─CH2─CHO
+
2
H+
+
2 e–
II- L'oxydant est introduit par
excès.
- On veut oxyder un l'alcool primaire utilisé en acide carboxylique grâce à
- une solution de permanganate de potassium
- en milieu
acide et mettre en évidence les produits de la réaction.
![]() Écrire l'équation bilan de la réaction.
Écrire l'équation bilan de la réaction.
-
Au cours d’une oxydation ménagée, la chaîne carbonée est
conservée.
|
|
Oxydation ménagée |
|
Oxydation ménagée |
|
|
CH3
–CH2 – CH2 –
OH |
→ |
CH3
–CH2 – CHO |
→ |
CH3
–CH2 – COOH |
|
Propan-1-ol |
Oxydant en défaut |
propanal |
Oxydant en excès |
Acide
propanoïque |
|
|
|
|
|
|
- Pour oxyder le propan-1-ol, on utilise une solution aqueuse de permanganate de potassium en milieu acide.
- On veut oxyder le pronal-1-ol (alcool primaire), en acide
propanoïque (acide carboxylique).
|
MnO4–
+ 8
H+
+ 5 e – =
Mn2+
+ 4 H2O |
|
CH3─CH2─CH2─OH
+ H2O =
CH3─CH2─COOH
+ 4
H+
+ 4 e– |
|
5 CH3─CH2─CH2─OH
+ 4 MnO4–
+ 12
H+ → 5
CH3─CH2─COOH + 4 Mn2+ + 11
H2O
|
-
Quantité de matière
n0
d'alcool utilisée :
-
On utilise :
-
1,0 mL de propan-1-ol pur :
-
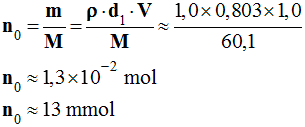
-
12,0 mL de solution de permanganate de potassium de
concentration C1 = 1,0 mol / L,
-
Quantité de matière
n1 ion permanganate
utilisé :
|
KMnO4 |
→ |
K+ (aq) |
+ |
MnO4–
(aq) |
|
n1 |
|
n1 |
|
n1 |
-
n1 =
C .
V ≈
1,0
×
12,0
×
10–3 mol
-
n1
≈ 12,0
×
10–3 mol
-
n1
≈ 12 mmol
-
7,0 mL de solution d’acide sulfurique de concentration
C2
= 5,0 mol / L
-
Quantité de matière
n2 d’ions
H+
(aq) utilisé :
|
H2SO4 |
→ |
2H+
(aq) |
+ |
SO42–
(aq) |
|
n |
|
2n = n2 |
|
n |
-
n2 = 2
C .
V ≈ 2
× 5,0
× 7,0
×
10–3 mol
-
n2
≈ 70
×
10–3 mol
-
n2
≈ 70 mmol
-
Tableau d’avancement de la réaction.
|
Équa. |
5 CH3─CH2─CH2─OH |
+ 4 MnO4–
(aq) |
+ 12
H+ (aq) |
→ |
5 CH3─CH2─COOH
(ℓ) |
+ 4 Mn2+
(aq) |
+
11 H2O (ℓ) |
|
|
mmol |
mmol |
mmol |
|
mmol |
mmol |
mmol |
|
État i |
n0 ≈
13 |
n1 ≈
12 |
n2 ≈ 70 |
|
0 |
0 |
– |
|
État x |
n0 – 5x |
n1 – 4x |
n2 –
12 x |
|
5 x |
4 x |
– |
|
État max |
n0 – 5xmax |
n1 – 4
xmax |
n2 –
12 xmax |
|
5 xmax |
4 xmax |
– |
-
Valeur
xmax de l’avancement maximal :
-
Il est égal à la plus petite des 3 valeurs
|
n0 – 5xmax0
= 0 |
n1 – 2
xmax1 = 0 |
n2 – 6
xmax2 = 0 |
|
|
|
|
-
En conséquence,
xmax =
xmax0
≈ 2,6 mmol
-
Le réactif limitant est bien le propan-1-ol.
-
La coloration violette persiste car il reste des ions
permanganate.
-
En fin de réaction :
|
Équa. |
5 CH3─CH2─CH2─OH |
+ 4 MnO4–
(aq) |
+ 12
H+
(aq) |
→ |
5 CH3─CH2─COOH
(ℓ) |
+ 4 Mn2+ (aq) |
+
11 H2O
(ℓ) |
|
|
mmol |
mmol |
mmol |
|
mmol |
mmol |
mmol |
|
État i |
n0 ≈
13 |
n1 ≈
12 |
n2 ≈ 70 |
|
0 |
0 |
– |
|
État x |
n0 – 5x |
n1 – 4x |
n2 –
12x |
|
5 x |
4 x |
– |
|
État f |
0,0 |
1,6 |
3,9 |
|
1,3 |
1,0 |
– |
a)- Expérience 1 : Réaction
d'oxydation
![]() Prendre un erlenmeyer
E1.
Prendre un erlenmeyer
E1.
-
Verser
1,0 mL de propan-1-ol.
-
Ajouter
12,0 mL de solution de permanganate de
potassium.
-
Puis ajouter délicatement et lentement
7,0 mL d'acide
sulfurique (attention aux projections).
-
On peut rajouter un peu d'eau distillée pour refroidir.
-
agiter et
laisser reposer.
b)- Expérience 2 : Extraction des
produits organiques de la phase aqueuse
![]() Dans l'erlenmeyer
E1, verser
2 à 3
mL d'hexane.
Dans l'erlenmeyer
E1, verser
2 à 3
mL d'hexane.
-
Boucher, agiter et laisser reposer.
c)-
Expérience 3 : Tests
d'identification
![]() Prendre l'erlenmeyer
E1,
Prendre l'erlenmeyer
E1,
-
Verser par moitié la phase organique qui surnage dans deux
tubes à essais T2 et
T3.
-
Faire le test à la D.N.P.H dans le tube
T2.
-
Faire le test au réactif de
schiff dans le tube
T3.
![]() Faire les schémas des différentes étapes du protocole
expérimental en indiquant les observations, le nom des réactifs et des
produits.
Faire les schémas des différentes étapes du protocole
expérimental en indiquant les observations, le nom des réactifs et des
produits.
|
|
|
|
|
|
![]() Quel type de réaction a lieu dans l'erlenmeyer
E1
?
Quel type de réaction a lieu dans l'erlenmeyer
E1
?
-
Dans l’erlenmeyer
E1, il se
produit l’oxydation du propan-1-ol (alcool primaire).
-
Les ions permanganate
MnO4– (aq)
(de coloration violette) ont été réduits en ions manganèse
Mn2+ (aq) (incolore).
-
Demi-équation électronique :
-
MnO4– (aq)+
8
H+ (aq)+
5 e–
=
Mn2+ (aq) +
4 H2O
(ℓ)
-
Il reste des ions permanganate car la coloration violette
persiste.
![]() Que concluez-vous d'après les résultats des tests effectués
dans T2
et T3
?
Que concluez-vous d'après les résultats des tests effectués
dans T2
et T3
?
-
Le teste à la
D.N.P.H est négatif, ainsi que le test au
réactif de SCHIFF.
- Remarque: Dans ce cas, le test au réactif de SCHIFF n’est pas nécessaire car le test à la D.N.P.H est négatif.
- Le produit
obtenu ne peut pas être un aldéhyde.
-
Le produit obtenu n’est pas un composé carbonylé.
-
Le produit obtenu est l’acide propanoïque.
-
CH3─CH2─CH2─OH +
H2O =
CH3─CH2─COOH
+
4
H+
+ 4
e–
B-
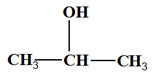
Oxydation
ménagée d'un alcool secondaire : le propan-2-ol.
I- L'oxydant est introduit par
défaut.
- On veut oxyder l'alcool secondaire en cétone grâce à
- une solution de permanganate de potassium
- en milieu acide et mettre en évidence
les produits de la réaction.
![]() Écrire l'équation bilan de la réaction.
Écrire l'équation bilan de la réaction.
-
On utilise
1,0 mL de propan-2-ol :
-
Calculer la masse
m d'alcool utilisée,
-
En déduire la quantité de matière
n0.
-
Quantité de matière de chacun des réactifs :
-
Masse d’alcool utilisée :
-
m =
ρ.d2.v
-
m = 1,0
x
0,786
x
1,0
-
m = 0,79 g
-
Quantité de matière de propan-2-ol :
-
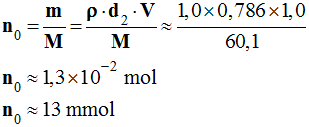
-
5,0 mL de solution de permanganate de potassium de
concentration C1 = 1,0 mol / L,
-
Quantité de matière
n1 ion permanganate
utilisé :
|
KMnO4 |
→ |
K+ (aq) |
+ |
MnO4–
(aq) |
|
n1 |
|
n1 |
|
n1 |
-
n1 =
C .
V ≈
1,0
×
5,0
×
10–3 mol
-
n1
≈ 5,0×
10–3 mol
-
n1
≈ 5,0 mmol
-
3,0 mL de solution d’acide sulfurique de concentration
C2
= 5,0 mol / L
-
Quantité de matière
n2 d’ions
H+
(aq) utilisé :
|
H2SO4 |
→ |
2H+ (aq) |
+ |
SO42– (aq) |
|
n |
|
2n = n2 |
|
n |
-
n2 = 2
C .
V ≈ 2
×
5,0
×
3,0
×
10–3 mol
-
n2
≈ 30
×
10–3 mol
-
n2
≈ 30 mmol
-
Équation bilan de la réaction :
|
MnO4–
+ 8
H+
+ 5 e – =
Mn2+
+ 4 H2O |
|
|
|
5
|
-
Tableau d’avancement de la réaction :
|
Équa. |
5 |
+ 2 MnO4–
(aq) |
+
6 H+ (aq) |
→ |
5
|
+ 2 Mn2+ (aq) |
+
8
H2O (ℓ) |
|
|
mmol |
mmol |
mmol |
|
mmol |
mmol |
mmol |
|
État i |
n0 ≈
13 |
n1 ≈
5,0 |
n2 ≈ 30 |
|
0 |
0 |
– |
|
État x |
n0 – 5x |
n0 – 2x |
n0 – 6x |
|
5 x |
2 x |
– |
|
État max |
n0 – 5xmax |
n0 – 2
xmax |
n0 – 6
xmax |
|
5 xmax |
2 xmax |
– |
-
Valeur
xmax de l’avancement maximal :
- Il est égal à la plus petite des 3 valeurs :
|
n0
– 5xmax0
= 0 |
n1
– 2
xmax1 = 0 |
n2
– 6
xmax2 = 0 |
|
|
|
|
-
En conséquence,
xmax =
xmax1
≈ 2,5 mmol
-
Le réactif limitant est bien l’ion permanganate.
-
La coloration violette due aux ions permanganate disparaît.
-
État final :
|
Équa. |
5 |
+ 2 MnO4–
(aq) |
+
6 H+ (aq) |
→ |
5 |
+ 2 Mn2+ (aq) |
+
8
H2O (ℓ) |
|
|
mmol |
mmol |
mmol |
|
mmol |
mmol |
mmol |
|
État i |
n0 ≈
13 |
n1 ≈
5,0 |
n2 ≈ 30 |
|
0 |
0 |
– |
|
État x |
n0 – 5x |
n0 – 2x |
n0 – 6x |
|
5 x |
2 x |
– |
|
État final |
0,50 |
0 |
15 |
|
12,5 |
5,0 |
– |
a)- Expérience 1 : Réaction
d'oxydation
![]() Prendre un tube à essais
T1.
Prendre un tube à essais
T1.
-
Verser
1,0 mL de propan-2-ol.
-
Ajouter
5,0 mL de solution de permanganate de
potassium.
-
Puis ajouter délicatement et lentement
3,0 mL d'acide
sulfurique (attention aux projections).
-
On peut rajouter un peu d'eau distillée pour refroidir.
-
Boucher, agiter et laisser reposer.
b)-
Expérience 2 : Extraction des
produits organiques de la phase aqueuse
![]() Dans le tube à essais
T1, verser
2
à 3 mL d'hexane.
Dans le tube à essais
T1, verser
2
à 3 mL d'hexane.
-
Boucher, agiter et laisser reposer.
c)-
Expérience 3 : Tests
d'identification
![]() Prendre le tube à essais
T1,
Prendre le tube à essais
T1,
-
Verser par moitié la phase organique qui surnage dans deux
tubes à essais T2 et
T3.
-
Faire le test à la D.N.P.H dans le tube
T2.
-
Faire le test au réactif de
schiff dans le tube
T3.
![]() Faire les schémas des différentes étapes du protocole
expérimental en indiquant les observations, le nom des réactifs et des
produits.
Faire les schémas des différentes étapes du protocole
expérimental en indiquant les observations, le nom des réactifs et des
produits.

![]() Quel type de réaction a lieu dans le tube
T1
?
Quel type de réaction a lieu dans le tube
T1
?
-
Dans le tube
T1, il se produit
l’oxydation du propan-2-ol (alcool secondaire).
-
Les ions permanganate
MnO4–
(aq) (de coloration violette) ont été réduits en ions manganèse
Mn2+ (aq) (incolore).
-
Demi-équation électronique :
-
MnO4– (aq)+
8
H+ (aq)+
5 e
–
=
Mn2+ (aq) +
4 H2O
(ℓ)
![]() Que concluez-vous d'après les résultats des tests effectués
dans T2
et T3
?
Que concluez-vous d'après les résultats des tests effectués
dans T2
et T3
?
-
Le test à la
D.N.P.H est positif. Le produit obtenu est
un composé carbonylé (aldéhyde ou cétone)
-
Le test au réactif de
schiff est négatif.
-
Le produit obtenu est une cétone : la propan-2-one (acétone).
-
Demi-équation électronique :
|
|
II- L'oxydant est introduit par
excès.
-
Est-il nécessaire de faire cette expérience ? Pourquoi ?
Justifier.






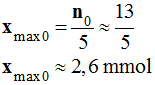
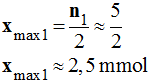
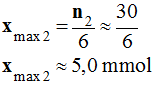







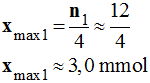
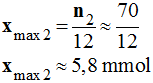




 =
=

