|
QCM N° 10 |
Dissolution de composés ioniques et solvatation |
|
|
|
|
QCM N° 10
Dissolution et Solvatation. Pour chaque question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Une solution contenant des ions
est : |
Une solution électrolytique |
Toujours colorée |
Électriquement neutre |
AC |
|
2 |
L’eau est un solvant |
Apolaire |
Polaire |
Qui comporte des liaisons polarisées |
BC |
|
3 |
Le tétrachlorométhane est un
solvant
|
Apolaire |
Polaire |
Qui comporte des liaisons polarisées |
AC |
|
4 |
Lors de la dissolution d’un solide ionique dans l’eau, les ions : |
Se dissocient du solide ionique |
Sont hydratés |
Se dispersent dans la solution |
ABC |
|
5 |
L’ion hydraté ci-dessous est :
|
Un anion |
Un cation |
De charge positive |
A |
|
6 |
L’éthanol est un composé polaire. Il est : |
Soluble dans
l’eau |
Insoluble dans
l’eau |
Soluble dans un solvant polaire |
AC |
|
7 |
La formule semi-développée de
l’hexane est : L’hexane est : |
Soluble dans
l’eau |
Insoluble dans
l’eau |
Soluble dans un solvant apolaire |
BC |
|
8 |
L’équation de dissolution duchlorure de cuivre II dans l’eau s’écrit : |
CuCℓ2 (s) → Cu2+ (aq) + Cℓ– (aq) |
CuCℓ2 (s) → 2 Cu2+ (aq) + Cℓ– (aq) |
CuCℓ2 (s) → Cu2+ (aq) + 2 Cℓ– (aq) |
C |
|
9 |
Une solution aqueuse de chlorure de cuivre II : |
Est électrolytique |
Contient deux fois plus d’ions cuivre II que d’ions chlorure |
Contient deux fois plus d’ions chlorure que d’ions cuivre II |
AC |
|
10 |
La concentration molaire de la solution précédente en soluté apporté est 0,40 mol / L. La concentration molaire en solution des ions chlorure est : |
0,80 mol / L |
0,40 mol / L |
0,20 mol / L |
A |
|
11 |
Pour la solution de chlorure de cuivre II, la relation entre les concentrations des ions dans la solution est : |
[Cu2+]
= [Cl–] |
[Cu2+]
= 2 [Cl–] |
2 [Cu2+]
= [Cl–] |
C |
|
12 |
L’atome de chlore est beaucoup plus électronégatif que l’atome d’hydrogène. La molécule de chlorure d’hydrogène HCl est : |
Chargée |
Polaire |
Apolaire |
B |
|
13 |
Une molécule présentant des atomes d’électronégativités différentes : |
Est forcément polaire |
Est forcément apolaire |
Peut être apolaire |
C |
|
14 |
On prépare un volume V = 100 mL d’unesolution aqueuse de chlorure de sodium par dissolution d’une quantité de matière n = 0,10 mol de chlorure de sodium solide NaCl (s). Alors : |
[Na+] = [Cl–] = 1,0 mol / L |
[Na+] = [Cl–] = 0,50 mol / L |
[Na+] = [Cl–] = 0,10 mol / L |
A |
|
15 |
Dans une solution aqueuse ionique contenant exclusivement des ions ferrique Fe3+ (aq) et de chlorure Cl– (aq), il y a : |
Autant d’ions chlorure que d’ions ferrique |
Trois fois plus d’ions chlorure que d’ions ferrique |
Trois fois plus d’ions ferrique que d’ions chlorure |
B |
|
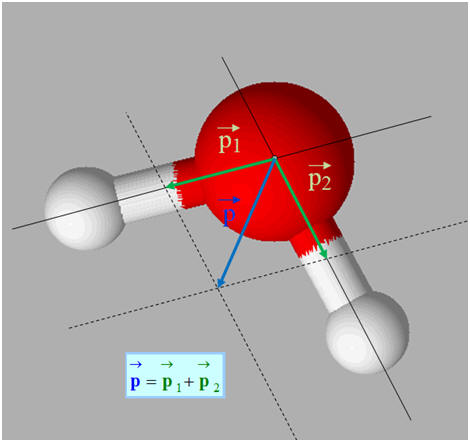
Molécule d'eau |
|
|
|
|
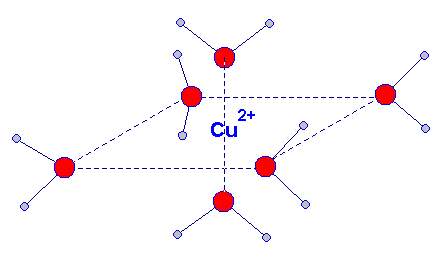
- Exemple : L’ion cuivre II solvaté s’entoure de 6 molécules d’eau, on le note : Cu (H2O)6 2+
- La notation simplifiée donne : Cu2+ (aq)..
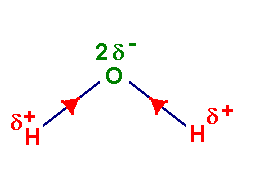
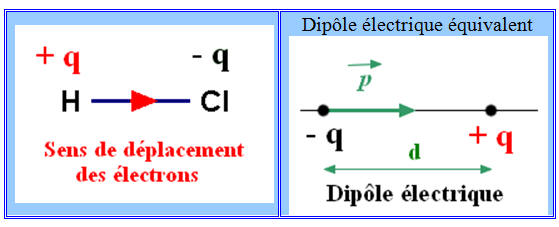
- La molécule de chlorure d’hydrogène a un caractère dipolaire : elle constitue un dipôle électrique.
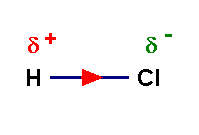
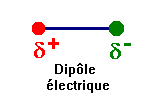
►
Solution électrolytique :
-
Une solution électrolytique est
une solution qui conduit le courant électrique car elle contient
des cations et anions.
-
Une solution électrolytique est
électriquement neutre. Elle contient autant de charges positives
que de charges négatives.
-
Les solvants polaires.
►
Solvant polaire :
-
Un solvant constitué de molécule
polaire est un solvant polaire.
-
L’eau H2O
est un solvant polaire. La molécule d’eau est une molécule
polaire.
-
La liaison H – O est une
liaison polarisée.
-
Ceci provient du fait que la
molécule d’eau est une molécule coudée.
►
Les solvants apolaires.
-
Un solvant constitué de molécule
apolaire est un solvant apolaire.
-
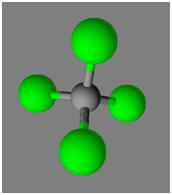
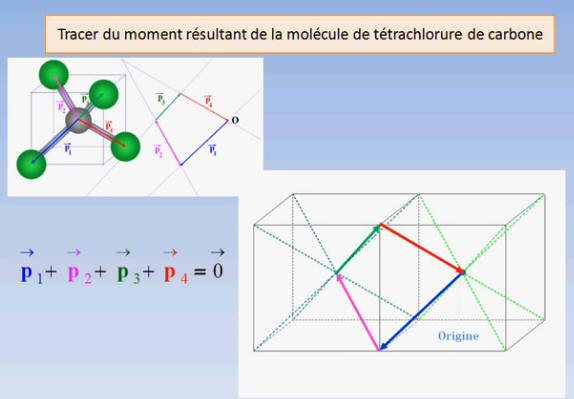
La molécule de tétrachlorure de
carbone est apolaire bien que la liaison C – Cl soit
polarisée.
-
Cette particularité est liée à la
géométrie de la molécule.
-
L’atome de carbone est au centre
d’un tétraèdre régulier dont les atomes de chlore occupent les
sommets.
-
La somme vectorielle de tous les
moments dipolaires est nulle.
Insertion du clip vidéo
►
Dissolution d’un solide ionique
dans l’eau :
-
La dissolution d’un cristal ionique dans un solvant polaire se
déroule en 3 étapes :
-
La dissociation des ions du solide ;
-
La solvatation des ions ;
-
La dispersion des ions dans le solvant.
-
Les solides ioniques sont très solubles dans les solvants
polaires.
-
Les ions s’entourent dans ce cas de molécules de solvant. On dit
qu’ils sont solvatés.
►
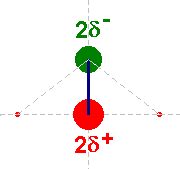
Hydratation des ions :
-
Cas d’un cation : l’ion sodium Na+
:
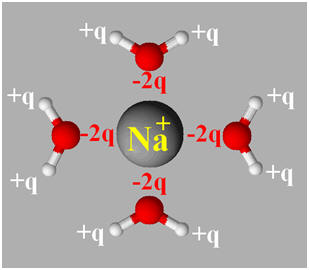
-
Cas d’un anion : l’ion chlorure
Cl– :
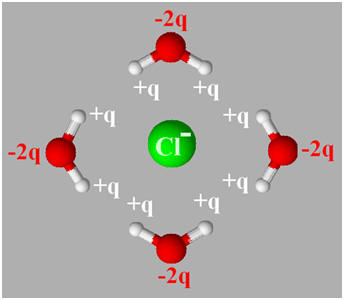
-
L’ion hydraté représenté
correspond à un anion.
►
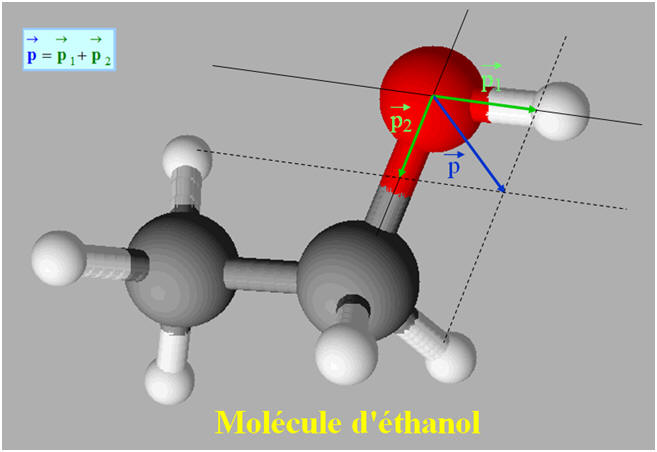
L’éthanol :
-
L’éthanol est un solvant polaire.
-
L’éthanol est un alcool que l’on
retrouve dans les boissons alcoolisées.
-
Sa formule brute est C2H6O.
-
Des petites quantités d'éthanol
provoquent un état euphorique.
-
Des doses plus importantes
dépriment gravement le système nerveux :
-
à consommer avec
modération !
-
L’éthanol est
miscible à l'eau en
toutes proportions.
-
L’éthanol, solvant polaire est
soluble dans les solvants polaires.
►
L’hexane :
-
Les molécules d’hexane,
d’heptane, d’octane, … sont des molécules apolaires.
-
Cela vient du fait que la liaison
C – H est faiblement polarisée.
-
Les solvants dont les molécules
ne comportent que des atomes de carbone et d’hydrogène sont
apolaires.
-
Ceci, même en l’absence de
symétrie de la molécule,
-
Les solutés moléculaires
apolaires ou peu polaires sont généralement solubles dans les
solvants apolaires.
-
L’hexane, soluté apolaire, est
soluble dans le solvant apolaire alors qu’il est très peu
soluble dans un solvant polaire (comme l’eau).
►
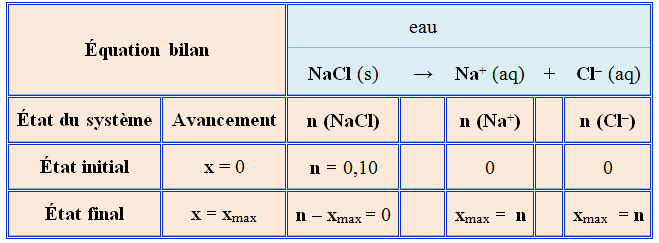
Dissolution du chlorure de cuivre
II :
-
Équation de dissolution dans
l’eau :
-
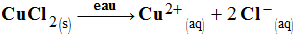
-
La formule CuCl2
est une formule statistique, d’un cristal ionique.
-
Elle indique que le cristal est
formé d’ions cuivre II et d’ions chlorure et qu’il y a 1 ion
cuivre II pour 2 ions chlorure.
-
La solution aqueuse de chlorure
de cuivre II est électriquement neutre.
-
Elle contient deux fois plus
d’ions chlorure que d’ions cuivre II.
►
Relation entre les
concentrations :
-
La concentration molaire
volumique C (s) en soluté apporté est égale au
quotient de la quantité de matière n (s) en soluté
apporté par le volume V de la solution :
|
|
|
|
Équation
bilan |
|
eau |
|
|
|
|
|
CuCl2
(s) |
→ |
Cu2+ (aq) |
+ |
2
Cl–
(aq) |
||
|
État du
système |
Avanc. |
n
(CuCl
2) |
|
n
(Cu2+) |
|
n
(Cl–) |
|
État initial |
x
=
0 |
n
(s) ≈ |
|
0 |
|
0 |
|
État final |
x
= xmax |
n
(s) – xmax
=
0 |
|
xmax
= n (s) |
|
2
xmax
= 2
n
(s) |
-
Concentration des ions cuivre II.
-
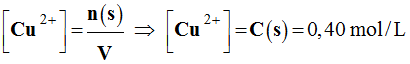
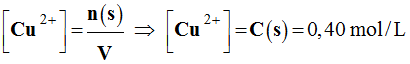
-
Concentration des ions chlorure :
-
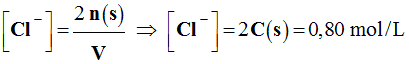
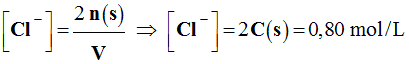
-
La concentration effective d’un
ion dans la solution peut être différente de la concentration en
soluté apporté.
-
Relation :
2 [Cu2+] = [Cl–]
►
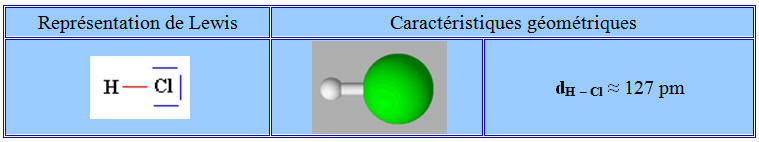
Molécule de chlorure d’hydrogène
HCl :
-
Le chlorure d’hydrogène est
constitué de molécules HCl dans lesquelles l’atome
d’hydrogène est lié à l’atome de chlore par une liaison
covalente.
-
Le chlore est beaucoup plus
électronégatif que l’hydrogène.
-
La molécule de chlorure
d’hydrogène a un caractère dipolaire : elle constitue un dipôle
électrique.
-
Elle peut être représentée par un
dipôle portant les charges – q et + q
-
La molécule de chlorure
d’hydrogène est une molécule polaire.
-
Une molécule présentant des
atomes d’électronégativité différente peut être polaire.
►
Solution aqueuse de chlorure de
sodium :
-
Concentration des ions sodium.
-
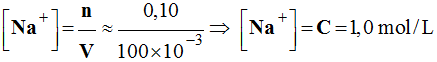
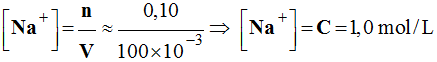
-
Concentration des ions chlorure :
-
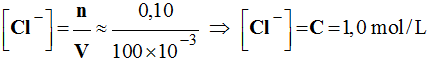
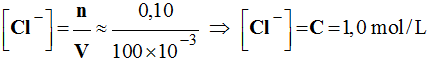
-
Relation : [Na+] = [Cl–]
= 1,0 mol / L
►
Solution de chlorure de fer III :
-
La solution aqueuse de chlorure
de fer III contient des ions fer III, Fe3+ (aq)
et des ions chlorure, Cl– (aq).
-
La solution aqueuse est
électriquement neutre.
-
Elle contient trois fois
plus d’ions chlorure, Cl– (aq) que d’ions
ferrique, Fe3+ (aq).
|
|