|
|
|
Temps et évolution chimique : Cinétique et catalyse. Programme 2012 : Programme 2020 |
Pour aller plus loin :
|
Mots clés : Catalyse ; catalyse homogène ; catalyse hétérogène ; La catalyse enzymatique ; sélectivité d'un catalyseur ; ... |
|
Chim. N° 12 |
La Catalyse : Exercices. Correction. Enoncé |
|
|
|
|
Temps et évolution chimique : Cinétique et catalyse. Programme 2012 : Programme 2020 |
Pour aller plus loin :
|
Mots clés : Catalyse ; catalyse homogène ; catalyse hétérogène ; La catalyse enzymatique ; sélectivité d'un catalyseur ; ... |
1)- Les couples qui interviennent :
- Potentiels d’oxydoréduction des différents couples : OX / Red :
- S2O82 –
(aq) / SO42 – (aq) ; E01 = 2,01 V- I2 (aq) / I– (aq) ; E02 = 0,54 V
- Les réactifs sont les ions iodure et les ions peroxodisulfate.
- Les ions peroxodisulfate (oxydant du couple S2O82 – (aq) / SO42 – (aq) ) sont réduits et les ions iodure (réducteur du couple I2 (aq) / I– (aq)) sont oxydés.
2)- Équation de la réaction (1).
|
S2O82– (aq) + 2 e – = 2 SO42– (aq) |
|
2 I– (aq) = I2 (aq) + 2 e– |
|
S2O82–
(aq) +
2
I–
(aq)
→ 2
SO42–
(aq) |
- La réaction est quasi-totale mais lente à la température ambiante.
3)- La catalyse :
- Réaction 2 :
|
2 Fe3+(aq) + 2 I– (aq) → I2 (aq) + 2 Fe2+(aq) |
- Réaction 3 :
|
2 Fe2+(aq) + S2O82 – (aq) → 2 Fe3+(aq) + 2 SO42 – (aq) |
- L’association des réactions (2) et (3) donne la réaction (1).
|
2 Fe3+(aq) + 2 I– (aq) → I2 (aq) + 2 Fe2+(aq) |
|
2 Fe 2+(aq) + S2O82 – (aq) → 2 Fe 3+(aq) + 2 SO42 – (aq) |
|
|
|
S2O82 –
(aq) + 2
I–
(aq) → 2
SO42–
(aq) |
- On s’aperçoit que les ions fer III participent aux réactions intermédiaires mais sont régénérés en fin de réaction.
- Ils n’apparaissent pas dans le bilan de la réaction (1). Ils catalysent la réaction (1).
- On remplace une réaction lente par deux réactions rapides.
- C’est le couple : Fe3+ / Fe2+ qui intervient.
|
- Définition d’un catalyseur : Un catalyseur est une substance qui accélère une réaction sans entrer dans le bilan de la réaction et sans modifier l’état final du système. |
- Ici, on a remplacé une réaction lente par deux réactions rapides.
- Les ions fer II ont participé aux réactions 1 et 2, mais ils n’interviennent pas dans le bilan global de la réaction.
- Ils ont été régénérés en fin de réaction.
- On dit que les ions fer II ont catalysé la réaction entre les ions peroxodisulfate et les ions iodure.
- Ils ont accéléré la réaction : l’ion fer II est un catalyseur de la réaction.
- Remarque : on peut aussi catalyser cette réaction avec les ions fer III.
4)- Expériences :
![]() Expérience 1 :
Expérience 1 :
- bécher A contenant 25 mL de solution aqueuse d’iodure de potassium.
- À l’instant t = 0, on verse 25 mL d’une solution de peroxodisulfate de potassium de concentration C = 0,10 mol / L.
- bécher B contenant 25 mL de solution aqueuse d’iodure de potassium.
- À l’instant t = 0, on verse 25 mL d’une solution de peroxodisulfate de potassium de concentration C = 0,10 mol / L
- et 10 gouttes d’une solution de chlorure de fer III de concentration C = 1,0 mol / L.
- bécher C contenant 25 mL de solution aqueuse d’iodure de potassium.
- À l’instant t = 0, on verse 25 mL d’une solution de peroxodisulfate de potassium de concentration C = 0,10 mol / L
- et 20 gouttes d’une solution de chlorure de fer III de concentration C = 1,0 mol / L.
- On observe l’évolution au cours du temps des différents mélanges réactionnels et on tire les conclusions.
1)- La 2, 4
–
DNPH permet de mettre en évidence la présence
du groupe carbonyle
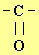 commun aux aldéhydes et aux cétones.
commun aux aldéhydes et aux cétones.
- Le
réactif de SCHIFF permet d’identifier le groupe aldéhyde
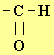 .
.
2)- Les réactions :
- Déshydratation de l’éthanol :
|
|
|
|
Al2O3 |
|
|
|
|
C2H5OH |
|
|
= |
CH2 = CH2 |
+ |
H2O |
|
Ethanol |
400 ° C |
Ethène |
|
- Déshydrogénation de l’éthanol :
|
|
|
|
Cu |
|
|
|
|
C2H5OH |
|
|
= |
CH3CHO |
+ |
H2 |
|
Ethanol |
280 ° C |
Ethanal |
|
|
|
|
|
Cu |
|
|
|
||
|
CH3 — CH2 — OH |
= |
CH 3 — |
C |
— H |
+ |
H2 |
||
|
|
280 ° C |
| | |
||||||
|
|
O |
|||||||
|
Ethanol |
|
Ethanal |
||||||
3)- Ces deux transformations mettent en évidence la sélectivités des catalyseurs.
1)- L’uréase est une enzyme qui catalyse la transformation de l’urée en carbonate d’ammonium.
2)- Vitesses de la réaction.
- Par définition :
- La vitesse volumique de réaction v (t) à la date t, est la dérivée par rapport au temps,
- Du rapport entre l’avancement x de la réaction et le volume V du milieu réactionnel.
- Relation :
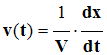
- avancement de la réaction : x: mol
- volume du milieu réactionnel : V: L
- Vitesse volumique de réaction : v (t) : mol / L / s
- Tableau d’avancement de la réaction :
|
Équation |
|
+ 2 H2O (ℓ) |
= |
2 NH4+ |
+ CO32 – |
||||||||||
|
état |
Avanc.
x (mol) |
|
|
|
|
|
|||||||||
|
État
initial (mol) |
0 |
C0V =
n
0 |
Excès |
|
0 |
0 |
|||||||||
|
Au
cours de la
transformation |
x
|
n0
–
x (t)
|
Excès |
2
x (t)
|
x
|
||||||||||
|
État
final (mol) |
xf |
n0
–
xf
|
Excès |
2
xf |
xf |
||||||||||
- À chaque instant t, dans le mélange réactionnel, la quantité de matière d’urée restant est liée à l’avancement temporel de la réaction par la relation :
- x (t) =
n0
– n
- 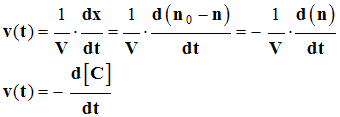
- Détermination graphique de la valeur de la vitesse à l’instant t.
- La vitesse volumique de la réaction à la date t1 est égale à l’opposée de la valeur du coefficient directeur de la tangente à la courbe C au point M1 d’abscisse t1.
- On trace la tangente à la courbe à l’instant considéré. La valeur de la vitesse est égale à l’opposée de la valeur du coefficient directeur de cette tangente.
- Valeur de la vitesse au temps t1 = 10 min.
- 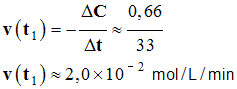
- Valeur de la vitesse au temps t2 = 60 min.
- La tangente est horizontale.
- La vitesse est nulle. La réaction est terminée.
- 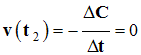
3)- Composition du mélange réactionnel à l’équilibre.
- La réaction chimique est terminée au bout de 50 min environ.
- Tableau d’avancement de la réaction : considérons que l’on travaille avec un litre de solution
|
Équation |
|
+ 2 H2O (ℓ) |
= |
2 NH4+ |
+ CO32 – |
||||||||||
|
état |
Avanc.
x (mol) |
|
|
|
|
|
|||||||||
|
État
initial (mol) |
0 |
C0 V = n0
= 1,0
mol |
Excès |
|
0 |
0 |
|||||||||
|
Au
cours de la
transformation |
x(t) |
1,0
– x (t) |
Excès |
2
x (t)
|
x
|
||||||||||
|
État
final (mol) |
xf |
1,0 – xf
= 0,32 mol |
Excès |
2 xf
= 1,36 mol |
xf = 0,68 mol |
||||||||||
- À l’équilibre, [Urée] ≈ 0,32 mol / L ; [NH4+] ≈ 1,36 mol / L et [CO32 –] ≈ 0,68 mol / L
- Taux d’avancement de la réaction :
|
τ = |
x f |
0,68 |
|||
|
|
≈ |
|
≈ |
68 % |
|
|
x max |
1,0 |
IV-
Exercice 23 page 306.
étude
d’un produit d’entretien de lentille.![]()
1)- Stabilité du peroxyde d’hydrogène.
a)- L’eau oxygénée peut subir une dismutation et jouer le rôle de réducteur et d’oxydant dans la même réaction :
|
H2O2
(aq)
+
H2O2
(aq)
=
O2
(g) |
|
Dismutation |
Réaction d'oxydoréduction au cours de laquelle une espèce chimique joue à la fois le rôle d'oxydant et de réducteur (ici l'eau oxygénée H2 O2 (aq)) H2 O2
(aq) /
H2O |
- Les deux couples mise en jeu :
- Couple 1 : H2O2 (aq) / 2 H2O (ℓ)
- Couple 2 : O2 (g) / H2O2 (aq)
b)- La dismutation du peroxyde d’hydrogène produit du dioxygène qui réagit au fur et à mesure qu’il se forme.
- C’est à cet instant qu’il est le plus réactif.
2)- Entretien des lentilles de contact.
- Première phase :
- le comprimé produit par dismutation du peroxyde d’hydrogène du dioxygène qui a des propriétés antiseptiques
- et une action mécanique sur le nettoyage grâce à l’effervescence.
- Seconde phase :
- Le comprimé libère la catalase (après 20 min).
- La catalase permet la décomposition rapide par catalyse du peroxyde d’hydrogène qui n’a pas réagi.
3)- Étude cinétique.
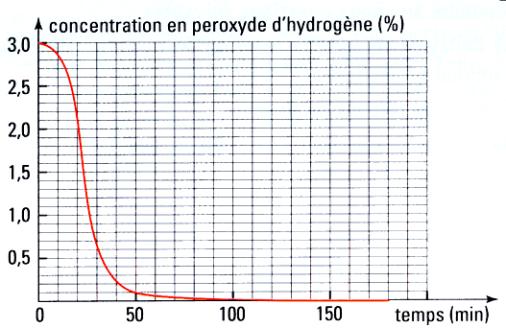
a)- Concentration de la solution après 20 min.
- La lecture graphique indique que la concentration de la solution 2,1 %.
- Comme : 2,1 % > 0,05 %, la solution est dangereuse pour les yeux.
- Les lentilles ne peuvent pas être portées.
- Concentration de la solution :
- La solution contient 2,1 g de H2O2 pour 100 mL de solution.
- 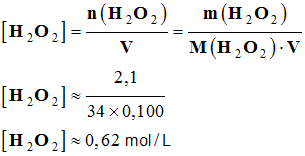
b)- temps de demi-réaction :
- Le temps de demi-réaction, noté t1/2, est la durée au bout de laquelle l’avancement de la réaction est égal à la moitié de sa valeur finale.
- En fin de réaction, le peroxyde d’hydrogène a totalement réagi.
- Au bout de t1/2, la concentration en peroxyde d’hydrogène est de 1,5 %.
- Par lecture graphique, t 1/2 ≈ 24 min.
c)- Définition de la vitesse de réaction.
- La vitesse volumique de réaction v (t) à la date t, est la dérivée par rapport au temps,
- Du rapport entre l’avancement x de la réaction et le volume V du milieu réactionnel.
- Relation :
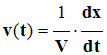
- avancement de la réaction : x: mol
- volume du milieu réactionnel : V: L
- Vitesse volumique de réaction : v(t) : mol / L / s
|
H2O2
(aq)
+
H2O2
(aq)
=
O2
(g) |
|
Équation |
2 H2O2 (aq) |
= |
O2 (g) |
+ 2 H2O (ℓ) |
|
|
état |
Avanc.
x (mol) |
|
|
|
|
|
État
initial (mol) |
0 |
C0
V =
n0 |
|
0 |
Excès |
|
Au
cours de la
transformation |
x (t) |
n0
–
2 x (t)
|
x
|
Excès |
|
|
État
final (mol) |
xf |
n
0
–
2 xf
|
xf |
Excès |
|
- À chaque instant t, dans le mélange réactionnel, la quantité de matière de peroxyde d’hydrogène restant est liée à l’avancement temporel de la réaction par la relation :
- 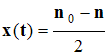 .
.
-
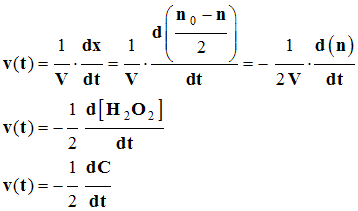
- On peut déterminer les valeurs des vitesses par la méthode des tangentes.
|
Vitesse volumique : - La vitesse volumique de la réaction à la date t1 est égale à l’opposée de la moitié de la valeur du coefficient directeur de la tangente à la courbe C au point M1 d’abscisse t1. |
- On trace la tangente à la courbe à l’instant considéré.
- La valeur de la vitesse est égale à l’opposée de la moitié de la valeur du coefficient directeur de cette tangente.
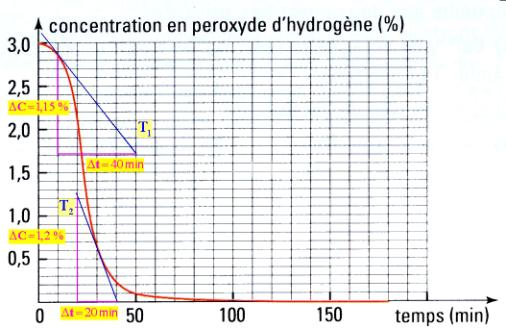
- Vitesse à t1 = 10 min.
- 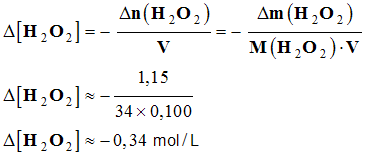
- 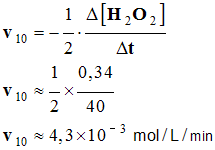
- Vitesse à t1 = 30 min.
- 
- 
d)- à partir de t = 20 min, la catalase est libérée et de ce fait catalyse la réaction de dismutation du peroxyde d’hydrogène
- et provoque une augmentation de la vitesse de la réaction.
1)- La réaction catalysée.
a)- Équation de la réaction.
- L’eau oxygénée peut subir une dismutation et jouer le rôle de réducteur et d’oxydant dans la même réaction :
|
H2O2
(aq)
+
H2O2
(aq)
=
O2
(g) |
- Les deux couples mise en jeu :
- Couple 1 : H2O2 (aq) / 2 H2O (ℓ)
- Couple 2 : O2 (g) / H2O2 (aq)
|
Dismutation |
Réaction d'oxydoréduction au cours de laquelle une espèce chimique joue à la fois le rôle d'oxydant et de réducteur (ici l'eau oxygénée H2 O2 (aq)) H2 O2
(aq) /
H2O |
b)- Le catalyseur : Un catalyseur est une substance qui accélère une réaction sans entrer dans le bilan de la réaction et sans modifier l’état final du système.
2)- Influence de la quantité de catalyseur.
a)- Origine expérimentale de la différence.
- Pour les groupes A et D, la quantité d’eau ajoutée est sensiblement la même.
- le groupe D a mis 5 fois plus de catalyseur.
b)- La vitesse de la réaction augmente avec la quantité de catalyseur ajouté.
3)- Étude cinétique.
a)- Les courbes : H2O2 = f (t)
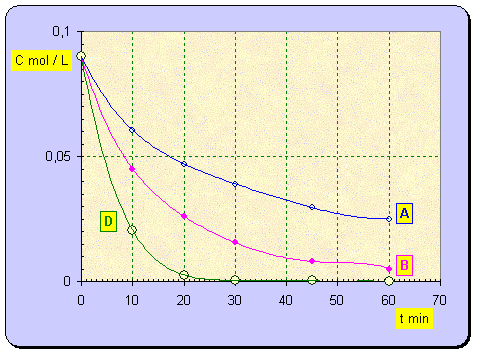
b)- Résultats du groupe C.
- Tableau de valeurs :
|
t
s |
CA
mol / L |
CB
mol / L |
CD
mol / L |
CC
mol / L |
|
0 |
0,09 |
0,090 |
0,090 |
0,090 |
|
10 |
0,0605 |
0,045 |
0,021 |
0,033 |
|
20 |
0,047 |
0,026 |
0,003 |
0,015 |
|
30 |
0,039 |
0,016 |
0,001 |
0,007 |
|
45 |
0,0295 |
0,008 |
0,000 |
0,003 |
|
60 |
0,025 |
0,005 |
0,000 |
0,002 |
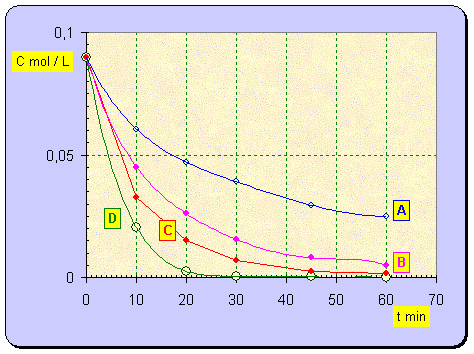
c)- Vitesse à t = 20 min.
- La vitesse volumique de réaction v (t) à la date t, est la dérivée par rapport au temps,
- Du rapport entre l’avancement x de la réaction et le volume V du milieu réactionnel.
- Relation :
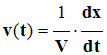
- avancement de la réaction : x: mol
- volume du milieu réactionnel : V: L
- Vitesse volumique de réaction : v (t) : mol / L / s
|
Équation |
2 H2O2 (aq) |
= |
O2 (g) |
+ 2 H2O (ℓ) |
|
|
état |
Avanc.
x (mol) |
|
|
|
|
|
État
initial (mol) |
0 |
C0
V =
n
0 |
|
0 |
Excès |
|
Au
cours de la
transformation |
x (t) |
n0
–
2 x (t)
|
x
|
Excès |
|
|
État
final (mol) |
xf |
n0
–
2 xf
|
xf |
Excès |
|
- À chaque instant t, dans le mélange réactionnel, la quantité de matière de peroxyde d’hydrogène restant est liée à l’avancement temporel de la réaction par la relation :
- 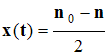 .
.
- 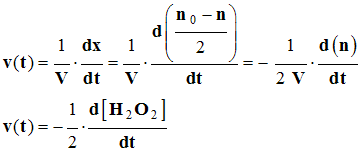
- On peut déterminer les valeurs des vitesses par la méthode des tangentes.
|
Vitesse volumique : - La vitesse volumique de la réaction à la date t1 est égale à l’opposée de la moitié de la valeur du coefficient directeur de la tangente à la courbe C au point M1 d’abscisse t1. |
- On trace la tangente à la courbe à l’instant considéré.
- La valeur de la vitesse est égale à l’opposée de la moitié de la valeur du coefficient directeur de cette tangente.

- 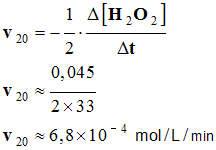
4)- Choix de la quantité de catalyseur.
a)- Comme on veut que la réaction soit terminée en une heure, il faut utiliser le mélange correspondant à la courbe C.
b)- Le volume de solution catalytique est V2 = 3 mL.