|
|
|
|
I- Les Savons : à propos des savons et de leur action suivant le milieu où ils agissent.
1)- Les savons peuvent être obtenus par saponification des corps gras.
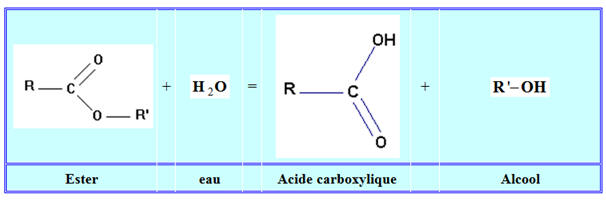
a)- Qu’est-ce qu’une réaction de saponification ? Quelle(s) caractéristique(s) la différencie(nt) de la réaction d’hydrolyse d’un ester ?
- Une réaction de saponification (ou hydrolyse basique) résulte de l’action des ions hydroxyde HO– en solution aqueuse sur un ester.
- Il se forme un alcool et un ion carboxylate.

- La réaction d’hydrolyse d’un ester est la réaction inverse de l’estérification.
- La réaction d’hydrolyse d’un ester est une réaction lente et limitée.
- La réaction de saponification une réaction lente mais totale.
- Les réactions d’hydrolyse et de saponification d’un ester sont toutes les deux des réactions lentes.
- La principale caractéristique qui les distingue est que, alors que l'hydrolyse est une réaction limitée par la réaction inverse d’estérification
et donne naissance à un équilibre chimique, la réaction de saponification, elle, est totale.
b)- Qu’est-ce qu’un corps gras ? Donner la formule générale d’un corps gras.
- Un corps gras est un triester d'acide gras et du glycérol. Les corps gras sont encore appelés triglycérides.
- Le glycérol est un trialcool : le propan-1, 2, 3 -triol.
- Un acide gras est un acide carboxylique à chaîne linéaire, saturée ou non, possédant en général un nombre pair d'atomes de carbone, entre 4 et 22.

c)- Écrire l’équation bilan de la réaction de saponification d’un corps gras.
- Équation bilan de la réaction de saponification d’un corps gras
2)- On dit que l’on ne peut pas utiliser un savon pour laver en milieu acide.
a)- En supposant que le savon contient essentiellement de l’oléate de sodium et en utilisant une échelle de pKA
indiquer quelle est la réaction prépondérante qui se produit entre une solution de ce savon et une solution d’acide fort.
- La solution de savon contient des ions oléate RCOO– (où R– désigne le groupement C17H33–) et des ions spectateurs Na+.
- En versant une solution d’acide fort, on ajoute des ions H3O+.
- Réaction prépondérante : elle est déduite de l’exploitation de l’échelle des pKA.
- On trace l’échelle des pKA en y portant les différents couples acido-basiques présents dans le mélange et en encadrant les espèces chimiques introduites :

- L’équation bilan de la réaction qui se produit dans la solution de savon lors de l’ajout d’une solution d’acide fort est la suivante :
RCOO–
+ H3O+ →
R–COOH +
H2O
-
Constante d’équilibre de la réaction :
Kr =
10 4,8 – 0 ≈ 6,3
× 104
- La réaction est quasi-totale.
b)- Indiquer ce que l’on va observer, qui explique que l’on ne puisse pas utiliser un savon en milieu acide.
- Il s’ensuit que de l’acide oléique apparaît en même temps que la quantité de matière d’ions oléate diminue.
- Ceci a deux principales conséquences :
- L’acide oléique étant pratiquement insoluble dans l’eau dans les conditions de l’expérience, il va précipiter.
- Il apparaît un trouble blanc dû à la présence de ce composé.
- Le pouvoir lavant du savon, dû aux ions oléate diminue.
- Voilà pourquoi il est déconseillé de laver en milieu acide avec un savon.
3)- Sur une étiquette de produit de lessive, on lit qu’il faut utiliser davantage de produit lorsque l’eau est dure,
c’est-à-dire quand l’eau contient des ions calcium ou magnésium en grande quantité. Cette question a pour but de justifier cette indication.
a)- Donner la formule d’un corps gras à partir duquel on peut préparer un savon constitué d’oléate de sodium.

- On peut donner la formule brute : C57H104O6
b)- Quelle masse de corps gras doit-on utiliser pour obtenir 100 g d’oléate de sodium ?
- La formule de l’oléate de sodium s’obtient en remplaçant, dans la molécule d’acide oléique, un atome d’hydrogène par un atome de sodium.
-
Acide oléique :
CH3–(CH2)7–CH=CH–(CH2)7–COOH
-
Oléate de sodium :
CH3–(CH2)7–CH=CH–(CH2)7–COONa
- M(Oléate) = 18 M (C) + 33 M (H) + 2 M (O) + M (Na)
- M(Oléate) ≈ 18 × 12,0 + 33 × 1,01 + 2 × 16,0 + 23,0
- M(Oléate) ≈ 304 g / mol
- Quantité de matière d’oléate de sodium correspondante :
-

- Tableau d’avancement :
|
|
Corps gras |
|
Soude |
|
Oléate de sodium |
|
Glycérol |
|
Équation bilan |
C57H104O6 |
+ |
3 (Na+ +
HO–) |
→ |
3
C18H33O2Na |
+ |
C3H8O3 |
|
État initial |
n |
|
Excès |
|
0 |
|
0 |
|
État
intermédiaire |
n – x |
|
Excès |
|
3 x |
|
x |
|
État final
|
n – xmax
= 0 |
|
Excès |
|
3 xmax =
n (Oléate) |
|
xmax |
- D’après le bilan de matière : on peut déterminer la valeur de la quantité de matière de corps gras :
-

- Calcul de la masse molaire du corps gras : C57H104O6
- M = 57 × 12,0 + 104 × 1,01 + 6 × 16,0
- M ≈ 885 mol / L
- Masse de corps gras nécessaire à l’obtention de 100 g d’oléate de sodium :
-
m =
n .
M
-
m ≈ 0,110
× 885
- m ≈ 97 g
a)- Indiquer, en utilisant le tableau de données, quel est le phénomène que l’on va observer lorsque l’on met le savon en solution dans l’eau.
|
Ions |
Oléate |
Éthanoate |
Palmitate |
|
Calcium |
précipité |
|
|
|
Sodium |
|
|
|
|
magnésium |
|
|
|
- L’eau utilisée contient des ions calcium en quantité non négligeable (dureté : 20 ° hydrométrique français).
- En conséquence, on va observer une réaction de précipitation : l’oléate de calcium précipite.
b)- Écrire l’équation bilan de la réaction qui traduit le phénomène observé.
Ca2+
(aq) + 2 C17H33–COO–
(aq) → (Ca(C17H33–COO)2)
(s)
c)- Calculer la masse de savon qui va rester disponible pour effectuer la lessive prévue. En déduire l’utilité de l’indication du fabricant.
- Quantité de matière d’ions calcium présents dans 25 L d’eau :
-

- Tableau d’avancement :
|
Équation bilan |
Ca2+
(aq) |
+ |
2 C17H33–COO–
(aq) |
→ |
(Ca(C17H33–COO)2)
(s) |
|
État initial |
n
(Ca2+) |
|
n
(Oléate) ≈ 0,329 mol |
|
0 |
|
État intermédiaire |
n
(Ca2+)
– x |
|
n
(Oléate) – 2 x |
|
x
|
|
État final
|
n
(Ca2+)
– xmax =
0 |
|
n
(Oléate) – 2 xmax |
|
3 xmax
= n (Oléate) |
- Quantité de matière d’oléate de sodium qui reste :
- nrestante (Oléate) = n (Oléate) – 2 xmax = n (Oléate) – 2 n (Ca2+)
- nrestante (Oléate) ≈ 0,329 – 2 × 0,050
- nrestante (Oléate) ≈ 0,23 mol
- Masse de savon disponible pour effectuer la lessive :
- mrestante (Oléate) = nrestante (Oléate) x M(Oléate)
- mrestante (Oléate) = 0,23 × 304
- mrestante (Oléate) = 70 g
- Pour compenser cette diminution de la masse d’oléate de sodium due à la formation du précipité,
il faut, ainsi que le conseille le fabricant, augmenter la dose de lessive lorsque l’eau de lavage est dure.
► Données :
-
pKA
du couple acide oléique / ion oléate : 4,8
-
pKA
du couple H3O+ /
H2O :
0,0
-
pKA
du couple H2O
/ HO– : 14
-
Formule de l’acide
oléique : C17H33COOH
- Masse molaire de l’acide oléique : 282 g / mol.
► Le tableau ci-dessous indique à l’aide d’une case grisée la formation d’un précipité lorsque les deux ions concernés sont mis en présence au cours de la réaction.
|
Ions |
Oléate |
Éthanoate |
Palmitate |
|
Calcium |
|
|
|
|
Sodium |
|
|
|
|
magnésium |
|
|
|
► Définition du degré hydrométrique français :
- Un degré hydrométrique français correspond à la présence de 0,10 mol d’ions calcium Ca2+ ou magnésium Mg2+ dans 1,0 m3 d’eau.
► Masses molaires :
-
M
(Ca) = 40,1 g / mol ;
M (Na) = 23,0 g / mol ;
M
(O) = 16,0 g / mol ;
M (C) = 12,0 g / mol
- M (H) = 1,01 g / mol
II- Détermination de l’indice d’acide d’une huile de table.
Une huile de table est essentiellement formée d’un mélange de triesters.
Cependant, une quantité faible et variable
d’acides gras libres peut être présente.
Le protocole proposé nous renseigne sur cette
quantité d’acide gras libre.
|
Huile d’olive : composition moyenne en acide gras (pourcentage massique) |
||
|
Nom |
Formule |
Pourcentage massique |
|
Acide oléique |
CH3–(CH2)7–CH=CH–(CH2)7–COOH |
78 % |
|
Acide linoléique |
CH3–(CH2)4–(CH=CH–CH2)2–(CH2)6–COOH |
10 % |
|
Acide palmitique |
CH3–(CH2)14–COOH |
9 % |
|
Acide stéarique |
CH3–(CH2)16–COOH |
3 % |
► L’huile d’olive est constituée essentiellement d(oléine, triester formé à partir de l’acide oléique et du glycérol.
► Données :
- Zone de virage (en pH) et couleurs de la phénolphtaléine : incolore 8,2 – 10,0 rose (indépendante du solvant utilisé).
► Masses molaires atomiques :
-
M
(K) = 39,1 g / mol ;
M (O) = 16,0 g / mol ;
-
M
(C) = 12,0 g / mol ;
M (H) = 1,01 g / mol
► L’éther éthylique et l’éthanol sont des solvants sans propriétés acido-basiques.
Dans un erlenmeyer de 250 mL, on mesure précisément une masse m = 100 g d’huile
puis on ajoute 40 mL d’éthanol,
40 mL d’éther éthylique permettant la dissolution de l’huile et quelques
de phénolphtaléine.
On agite pour homogénéiser le mélange.
On réalise le dosage du mélange contenu dans l’erlenmeyer par une solution S de potasse alcoolique (hydroxyde de potassium en solution dans l’éthanol) de concentration :
C = 5,0
× 10– 2
mol / L.
On considère que l’hydroxyde de potassium dans l’éthanol a le même comportement que dans l’eau.
Le virage de l’indicateur coloré est obtenu pour
un volume d’hydroxyde de potassium versé de 6,2 mL.
1)- Lecture de l’étiquette de l’huile de table.
a)- Donner la définition d’un acide gras.
- Un acide gras est un acide carboxylique à longue chaîne carbonée non ramifiée et comportant un nombre pair d’atomes de carbone.
- S’il comporte au moins une double liaison, l’acide gras est dit insaturé.
- Il est dit saturé dans le cas contraire :
- Exemple :
-
Acide gras saturé : Acide palmitique :
CH3–(CH2)14–COOH
-
Acide gras insaturé : Acide oléique :
CH3–(CH2)7–CH=CH–(CH2)7–COOH
b)- Préciser le nom de la famille de corps obtenus par réaction du propane –1, 2, 3–triol (glycérol) avec des acides gras.
- Lorsque le glycérol (trialcool : le propan-1, 2, 3 -triol) réagit avec des acides gras (acides carboxyliques), il se forme des triesters, aussi appelés triglycérides ou lipides.
- C’est une réaction d’estérification.
- Exemple :
a)- Préciser le rôle joué par la phénolphtaléine dans le dosage.
- Rôle joué par la phénolphtaléine dans le dosage :
- La phénolphtaléine est destinée à repérer par son changement de coloration (incolore → rose) le passage
par l’équivalence lors du dosage par l’hydroxyde de sodium des acides gras libres présents en faible quantité dans l’huile.
b)- Faire un schéma expérimental utilisé pour le dosage de l’huile.
- Schéma du dispositif expérimental utilisé pour le dosage :
c)- La fabrication du savon peut être envisagée par réaction d’un triester avec la soude ou la potasse.
Connaissant les caractéristiques de cette réaction, expliquer pourquoi son influence n’est pas à envisager dans ce dosage.
- Les réactions de saponification sont des réactions qui sont totales mais lentes, même à chaud.
- Or, dans le protocole expérimental, on opère à froid et la réaction acide-base qui se produit lors du dosage est une réaction rapide et totale.
- De plus le dosage est réalisé en quelques minutes.
- La réaction de saponification n’a ainsi pas le temps de se produire.
- C’et donc pour des raisons cinétiques que l’influence de la saponification sur le dosage n’a pas été envisagée.
a)- Écrire l’équation bilan de la réaction ayant lieu au cours du dosage (on admet, pour simplifier, que RCOOH est la formule de l’ensemble des acides présents).
- Équation bilan de la réaction ayant lieu au cours du dosage :
- Il est indiqué dans l’énoncé que l’ion hydroxyde a les mêmes propriétés en solution alcoolique qu’en solution aqueuse.
- La réaction fait intervenir les ions hydroxyde et les acide gras libres de formule générales RCOOH présents dans l’huile
- En conséquence, on écrit :
RCOOH
+ HO– →
RCOO–
+ H2O
- C’est une réaction totale, rapide, unique puisqu’elle est le support d’un dosage.
b)- Définir la notion d’équivalence dans un dosage. En déduire la relation à l’équivalence entre les quantités de matière des réactifs.
- Définition générale de l’équivalence :
- Pour un dosage, l’équivalence est atteinte lorsque les réactifs ont été mélangés dans les proportions stœchiométriques indiquées par l’équation bilan de la réaction support du dosage.
- On note n (Acide) : la quantité de matière d’acide gras initialement introduite dans l’erlenmeyer.
- On note n (Base)eq : la quantité de matière d’ions hydroxyde ajoutée à l’équivalence.
- Compte tenu de la stœchiométrie de la réaction support du dosage :
- Relation à l’équivalence :
- n (Acide) = n (Base)eq
4)- Exploitation des mesures : détermination de l’indice d’acide de l’huile de table.
On appelle indice d’acide d’une huile de table,
la masse d’hydroxyde de potassium, exprimée en milligrammes, nécessaire
au dosage de tous les acides contenus dans 1,0 g de cette huile.
a)- Exprimer la quantité de matière d’hydroxyde de potassium nécessaire au dosage des acides gras libres présents dans 10 g d’huile.
- Quantité de matière d’hydroxyde de potassium nécessaire au dosage des acides gras libres présents dans 10 g d’huile :
-
n (Base)eq =
C . V ≈ 5,0
× 10– 2 ×
6,2
× 10– 3
- n (Base)eq ≈ 3,1 × 10– 4 mol
b)- En déduire l’indice d’acide de l’huile de table.
- Indice d’acide de l’huile de table :
- Quantité de matière d’hydroxyde de potassium nécessaire pour neutraliser les acides gras libres présents dans 10 g d’huile :
- n (KOH)10 = n (Base)eq
- On ramène cette valeur à 1 g d’huile :
- n (KOH)1 ≈ 3,1 × 10 – 5 mol (il suffit de diviser la valeur précédente par 10)
- Masse d’hydroxyde de potassium correspondante :
-
m
(KOH)1 =
n (KOH)1
. M
(KOH)
- m (KOH)1 ≈ 3,1 × 10– 5 × (39,1 + 16,0 + 1,01)
- m (KOH)1 ≈ 1,7 mg
- Un indice est en général un nombre sans dimension et compte tenu de la définition de l’indice d’acide, on donne le résultat sous la forme suivante :
- I.A = 1,7
|
|