|
TP Chimie N° 12 :
Correction
Autre formulation 2004 |
|
|
|
A- Synthèse de l'éthanoate de 3-méthylbutyle.
I- Données.
|
|
M g / mol |
densité |
θ ébullition °C |
Solubilité dans l'eau |
|
Acide éthanoïque |
60 |
1,05 |
118,2 |
Grande |
|
Alcool isoamylique |
88 |
0,81 |
128 |
Faible |
|
Éthanoate de 3-méthylbutyle |
130 |
0,87 |
142 |
Très faible |
II- Manipulation.
1)- Préparation de l'ester.
a)- Chauffage à reflux.
![]() Introduire dans le ballon :
Introduire dans le ballon :
- 15 mL d'alcool isoamylique à 98 % (3-méthylbutan-1-ol).
- 20 mL d'acide acétique à 99 % (acide éthanoïque).
- Quelques grains de pierre ponce ou quelques billes de verre.
- Adapter le réfrigérant et porter le mélange à l'ébullition douce pendant 45 min.
- Ne pas oublier de graisser les rodages.
b)- Questions : pendant que la réaction s'effectue.
- Écrire l'équation bilan de la réaction. Donner la classe de l'alcool utilisé.
Réponse :
L'alcool utilisé est un alcool primaire.
- Calculer les quantités de matière de chacun des réactifs mis en jeu.
Quantité de matière d'alcool isoamylique :
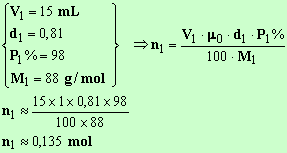
Quantité de matière d'acide éthanoïque
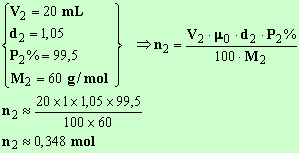
- L'un des réactifs est en excès. Lequel ? Pourquoi ? Que peut-on dire du rendement de la réaction d'estérification ?
La réaction se faisant mole à mole, il y a un excès d'acide éthanoïque (réactif le moins cher).
On utilise un excès d'acide éthanoïque pour déplacer l'équilibre dans le sens de l'estérification.
On est en présence d'un alcool primaire, en conséquence, le rendement est supérieur à 66 %.
Le rendement se calcule par rapport au réactif en défaut.
La réaction est déplacée dans le sens de l'estérification :
rendement théorique :
![]()
- Faire un schéma du dispositif. Qu'appelle-t-on chauffage à reflux ?
|
Chauffage
à Reflux
|
1-
réfrigérant.
2-
Ballon.
3-
Chauffe-ballon.
4-
Sortie de l’eau.
5-
Arrivée de l’eau.
6-
Mélange réactionnel.
7-
Vallet. |
Ce montage permet de maintenir le milieu réactionnel à une température constante, en l'occurrence la température d'ébullition du solvant.
Les vapeurs sont condensées dans le réfrigérant et retournent à l'état liquide dans le ballon.
Les réactifs et les produits restent dans le milieu réactionnel.
2)- Séparation de l'ester.
a)- Extraction liquide - liquide.
- Laisser refroidir à température ambiante, puis refroidir avec un récipient contenant de l'eau glacée.
- Verser le contenu du ballon dans un bécher (de 250 mL) contenant 50 mL d'eau froide. Rincer le ballon avec de l'eau distillée.
- Verser le mélange dans une ampoule à décanter et séparer les deux phases.
- Recueillir la phase organique et la laver avec 15 mL de solution d'hydrogénocarbonate de sodium à 5 %.
- Dégazer et attendre que l'effervescence cesse pour décanter. Recommencer plusieurs fois si nécessaire.
- Laver la phase organique avec 20 mL d'eau salée.
- Verser la phase organique dans un bécher propre et sec et sécher avec environ 2 g de sulfate de magnésium anhydre.
b)- Filtration liquide - solide.
- Filtrer et mesurer le volume et la masse de l'ester formé :
VE = et mE =
c)- Questions :
- Pourquoi est-il important de refroidir le milieu réactionnel avant d'ajouter de l'eau ?
On refroidit afin d'éviter l'hydrolyse de l'ester.
- Dans l'ampoule à décanter, où se trouve la phase aqueuse et la phase organique ? Quelle est la phase qui contient pratiquement tout l'ester ?
La phase organique est moins dense que l'eau, elle se trouve au-dessus de la phase aqueuse.
L'ester se trouve principalement dans la phase organique car il est peu soluble dans l'eau.
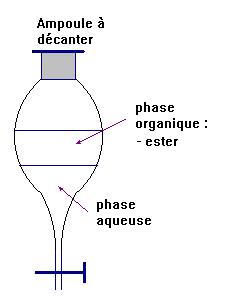
- Pourquoi propose-t-on d'ajouter une solution de chlorure de sodium pour améliorer la séparation ?
Le chlorure de sodium joue un double rôle, il améliore la séparation en augmentant la densité de la phase aqueuse et de plus, l'ester est moins soluble dans l'eau salée.
- Quel est le rôle de l'hydrogénocarbonate de sodium ?
CO2,
H2O / HCO3 –, pKA1
= 6,4 ; HCO3– / CO32 –
, pKA2 = 10,2
L'hydrogénocarbonate de sodium est une solution basique, elle neutralise le milieu réactionnel et élimine l'acide éthanoïque restant en le solubilisant dans l'eau sous forme d'ions éthanoate.
- Faire un schéma des différentes extractions.
III- Exploitation des mesures.
- Déterminer la densité de l'ester. Comparer la valeur trouvée à celle donnée dans le tableau. Conclure.
- Calculer la quantité d'ester obtenu. En déduire le pourcentage d'alcool et d'acide estérifié. Ce résultat vous semble-t-il convenable ? Justifier.
- Calculer le rendement de la réaction.
- Donner les caractéristiques de l'ester obtenu.
Densité de l'ester :

La valeur donnée dans le tableau est d ≈ 0,87.
L'ester n'est pas pur, il contient un peu d'eau, il faudrait réaliser une distillation fractionnée.
Quantité d'ester obtenu :
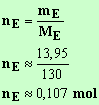
Pourcentage d'acide estérifié :
![]()
Pourcentage d'alcool estérifié :
![]()
Rendement de la réaction. Il se calcule par rapport au réactif limitant :
![]()
Le pourcentage est supérieur à 66 %. Il y a pour cela deux raisons.
Le mélange n'est pas équimolaire, il y a un excès d'acide carboxylique et l'équilibre est déplacé dans le sens de l'estérification.
Le produit n'est pas pur, il contient de l'eau en outre.
B- Synthèse du méthanoate d'éthyle.
I- Données.
|
|
M g / mol |
densité |
θ ébullition °C |
Solubilité dans l'eau |
|
Acide méthanoïque |
46 |
1,05 |
100,7 |
Grande |
|
Éthanol |
46 |
0,81 |
78 |
Grande |
|
Méthanoate d'éthyle |
74 |
0,92 |
54,5 |
faible |
|
Eau |
18 |
1 |
100 |
----------- |
II- Manipulation.
1)- Distillation :
a)- Matériel : on utilise :
- Un ballon de 250 mL.
- Une colonne de Vigreux (colonne à distillée)
- Un réfrigérant descendant.
- Un thermomètre
- Une éprouvette pour recueillir le distillat.
- Ne pas oublier de graisser les rodages.
b)- Réactifs :
- 20 mL d'acide formique (acide méthanoïque).
- 20 mL d'éthanol.
- Quelques gouttes d'acide sulfurique.
- Quelques grains de pierre ponce ou quelques billes de verre.
c)- Réaction : on porte à l'ébullition douce et on recueille le distillat dans l'éprouvette graduée.
2)- Mesures.
- Relever la température θ en tête de colonne : θ = 52 °C.
- Relever la valeur de la pression : P = 1001 hPa.
- Déterminer la masse et le volume de l'ester obtenu. En déduire la densité du produit obtenu.
- La comparer à la valeur donnée dans le tableau.
Densité de l'ester :
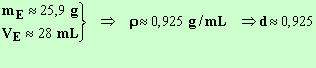
La valeur donnée dans le tableau est d ≈ 0,92.
- L'ester est pratiquement pur, il a été obtenu par distillation fractionnée.
III- Exploitation.
- Écrire l'équation bilan de la réaction.
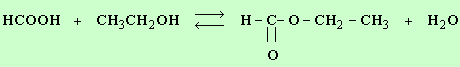
- Déterminer les quantités de matière de chacun des réactifs mis en jeu. Conclure.
Quantité de matière d'acide méthanoïque :
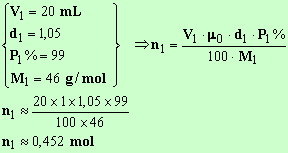
Quantité de matière d'éthanol
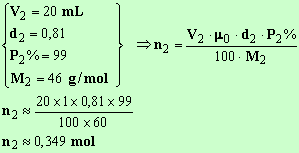
Il y a un excès d'acide formique, l'équilibre est déplacé dans le sens de l'estérification.
- Faire un schéma annoté du montage utilisé.
|
(1)‑Chauffe-ballon. (2)‑Mélange. (3)‑Colonne de Vigreux. (4)‑Thermomètre. (5)‑Arrivée et Sortie de l’eau. (6)‑Condenseur. (7)‑Éprouvette. (8)‑Distillat. (9)- Support élévateur (Vallet) |
- Qu'appelle-t-on distillation fractionnée ?
Au cours de la distillation fractionnée, les réactifs et les produits se vaporisent et monte dans la colonne à distillée.
Au cours de l'ascension, le mélange s'enrichi en corps le plus volatil (ici l'ester).
En tête de colonne, on obtient le corps le plus volatil pratiquement pur.
Le distillat est ensuite condensé grâce au réfrigérant.
- Déterminer la quantité d'ester obtenu.
Quantité d'ester obtenu :
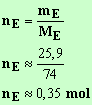
- Calculer le rendement de la réaction. Conclure.
Rendement de la réaction : il se calcule par rapport au réactif limitant :
![]()
Le rendement est proche de 1, car on extrait l'ester au fur et à mesure qu'il se forme.
On déplace l'équilibre dans le sens de l'estérification.
- Donner les caractéristiques de l'ester obtenu.
L'ester obtenu est pratiquement pur.