|
|
Annales du Bac (1998)
|
|
|
Annales du Bac (1998)
|
Un détartrant de cafetière est commercialisé sous forme de sachets de poudre portant la seule indication : Acide sulfamique. L’acide sulfamique (ou acide amidosulfurique) est considéré comme un acide fort de formule :
NH2SO3H
que l’on notera AH.
On
se propose d’effectuer le dosage de cet acide, de vérifier la pureté du produit
contenu dans le sachet et d’étudier son action sur le tartre.
Pour
cela, on pèse 1,0 g de détartrant que l’on dissout dans l’eau distillée de
manière à obtenir exactement 100,0 mL d’une solution S. On prélève ensuite 20,0 mL de cette solution et on procède à son dosage par une solution titrée de soude
(solution d’hydroxyde de
sodium) de concentration 0,10
mol . L–1.
Ce
dosage est suivi par pH-métrie (voir courbe ci-après) : |
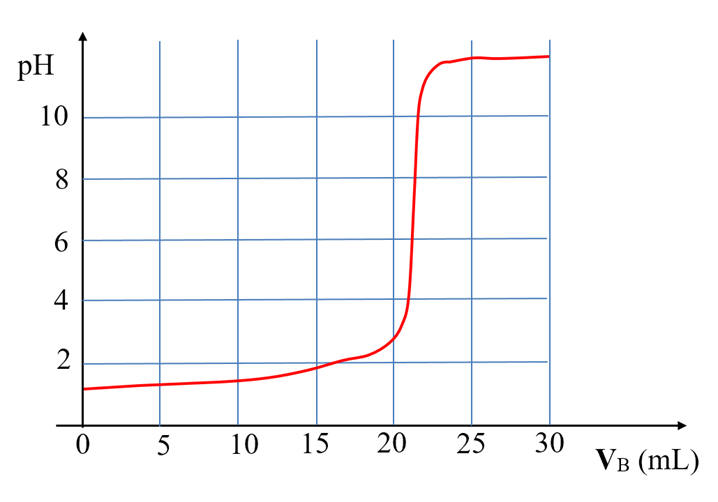
|
Données : Acide sulfamique : : NH2SO3H : 97 g . mol–1 ;température de fusion : 200 °C Solubilité : 147 g . L–1 dans l’eau froide. Valeurs des
pKA à 25 °C (température
de l’expérience) : H2O / HO – : pKA = 14 ; H3O+ / H2O : pKA = 0 ; HCO3– / CO32– : pKA = 10,2 ;
CO2,
H2O /
HCO3–
;
pKA = 6,4
1)- Écrire
l’équation-bilan de la réaction qui a lieu lors de la mise en solution de
l’acide sulfamique (0,25 pt).
2)- Première partie :
a)- Écrire l’équation-bilan de la réaction chimique
support du dosage (0,25 pt).
b)- Définir l’équivalence du dosage acido-basique
(0,25 pt).
c)- À partir de la courbe, déterminer les coordonnées
du point d’équivalence, en précisant la méthode choisie (0,5 pt).
d)- Déterminer à partir du dosage la quantité d’acide
sulfamique contenue dans la prise d’essai, puis vérifier si l’indication portée
sur le sachet est correcte (1,25 pt).
3)- Deuxième partie :
On
se propose d’étudier l’action de cette solution de détartrant sur un dépôt de
tartre. Le
tartre est essentiellement constitué d’un dépôt de carbonate de calcium, solide
constitué d’ions calcium Ca2+ et
d’ions carbonate
CO32–.
a)- Placer sur un axe de
pKA les
quatre couples acide-base des
données ci-dessus (0,25 pt).
b)- Écrire l’équation-bilan de la réaction qui se
produit lorsque la solution de détartrant entre en contact avec le dépôt de
tartre (0,25 pt).
c)- Montrer que cette réaction peut être considérée
comme totale (0,5 pt).
d)- Dans certaines conditions, quand on utilise ce
détartrant, on peut observer un dégagement gazeux. Quel est ce gaz ? Justifier
sa formation (0,5 pt).
|
|
Les
mesures sont effectuées à 25 °C. Couples
acide-base :
- Acide éthanoïque / ion éthanoate :
pKA1
= 4,7
- Ion ammonium / ammoniac :
pKA2
= 9,2
- Couples de l’eau :
- H3O+ /
H2O
:
pKA
= 0
- H2O
/ HO– :
pKA
= 14 . 1)- Soit une solution S1 d’acide éthanoïque de concentration C1 = 2,0
×
10 –2 mol . L–1.
a)- Écrire l’équation-bilan de la réaction de l’acide
avec l’eau (0,25 pt). b)- Exprimer et calculer la constante de cette réaction.
Peut-on dire que l’acide éthanoïque est un acide faible dans l’eau ?
(0,75 pt). c)- La mesure du pH de la solution donne 3,2.
Confirme-t-elle le résultat précédent ? (0,5 pt). 2)- Soit une solution S2 d’acide éthanoïque de concentration C2 = 1,0
×
10 –2 mol . L–1.
a)- Écrire l’équation-bilan de la réaction de
l’ammoniac sur l’eau (0,25 pt). b)- Exprimer et calculer la constante de cette réaction.
Peut-on dire que l’ammoniac est une base faible dans l’eau ? (0,75
pt). c)- La mesure du pH de la solution donne 10,6.
Confirme-t-elle le résultat précédent ? (0,5 pt).
3)- À un volume
V
de solution S1, on ajoute un même volume
V de
solution
S2 (1 pt).
Écrire
l’équation de la réaction qui a lieu. Calculer
sa constante.
Montrer
que l’on peut considérer la réaction comme totale.
En
déduire la valeur du pH de la solution obtenue.
|
|
|
|
|