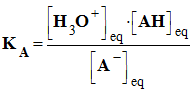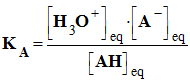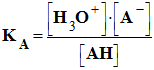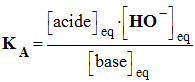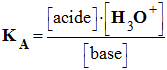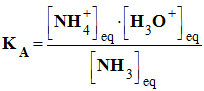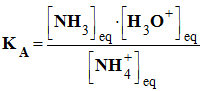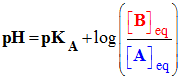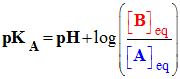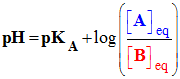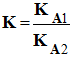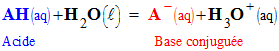|
QCM N° 05 |
Réactions acido-basiques Cours : 2010 Cours : 2018 Cours : 2000 |
|
|
|
Réactions acido-basiques Pour chaque question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
À 25 ° C, le produit ionique de l’eau :
Ke = [H3O+]eq
. [HO
–
]eq
Cette constant d’équilibre est associée à la réaction : |
H3O+ (aq) + HO–
(aq)
|
H3O+ (aq) + HO–
(aq) |
|
B |
|
2 |
L’autoprotolyse de l’eau : |
Est une réaction très limitée |
Est une réaction totale |
Est une réaction acido-basique |
AC |
|
3 |
On affirme que seulement 2 molécules d’eau sur 556 millions participent à la formation des ions H3O+ et HO –. Le taux d’avancement final τ de la réaction d’autoprotolyse de l’eau vaut : |
τ ≈ 1 |
τ ≈ 3,6 × 10 – 9 |
τ ≈ 1,0 × 10 – 7 |
B |
|
4 |
La constante d’équilibre associée à l’équation d’autoprotolyse de l’eau, notée Ke est appelé produit ionique de l’eau. On donne : À 25 ° C, pKe = 14 À 60 ° C, pKe = 13 |
La constante Ke est valable pour toutes les solutions aqueuses |
La constante Ke augmente avec la température |
La constante Ke diminue avec la température |
AB |
|
5 |
Au produit ionique de l’eau, on associe une autre grandeur nommée pKe. Cette grandeur est définie par la relation : |
Ke = – log (pKe) |
Ke = 10– pKe |
Ke = – pKe |
B |
|
6 |
Une solution neutre : |
Contient plus d’ions hydroxyde que d’ions oxonium |
Contient moins d’ions hydroxyde que d’ions oxonium |
Contient autant d’ions hydroxyde que d’ions oxonium |
C |
|
7 |
Une solution acide : |
Contient plus d’ions hydroxyde que d’ions oxonium |
Contient moins d’ions hydroxyde que d’ions oxonium |
Contient autant d’ions hydroxyde que d’ions oxonium
|
B |
|
8 |
Une solution basique : |
Contient plus d’ions hydroxyde que d’ions oxonium |
Contient moins d’ions hydroxyde que d’ions oxonium |
Contient autant d’ions hydroxyde que d’ions oxonium |
A |
|
9 |
On donne : À 25 ° C, pKe = 14 À 60 ° C, pKe = 13 À 60 °C, une solution de pH = 7,0 est : |
Acide |
Basique |
Neutre |
B |
|
10 |
Une solution est acide si : |
|
|
|
C |
|
11 |
La constante d’acidité KA associée à la réaction entre un acide AH (aq) et l’eau a pour expression : |
|
|
|
B |
|
12 |
L’expression générale de la constante d’acidité KA est : |
|
|
|
C |
|
13 |
L’expression de la constante d’acidité du couple NH4 (aq) / NH3 (aq) est : |
|
|
|
C |
|
14 14 |
Pour tout couple Acide / Base, noté B : |
|
|
|
A |
|
15 |
Pour les solutions d’acides de mêmes concentrations C : |
Le pH est d’autant plus grand que le KA est grand |
Le pH est d’autant plus faible que le KA est grand |
Le taux d’avancement final τ est d’autant plus grand que le KA est grand |
BC |
|
16 |
Pour les solutions d’acides de mêmes concentrations C : |
Le pH est d’autant plus faible que le pKA petit. |
L’acide est d’autant plus dissocié que le pKA grand |
Le taux d’avancement final τ est d’autant plus grand que le pKA grand |
A |
|
17 |
Pour les solutions de bases de mêmes concentrations C : |
Le pH est d’autant plus élevé que le KA est petit |
Le taux d’avancement final τ est d’autant plus grand que le KA est petit |
La base est d’autant plus dissociée que le KA est grand |
AB |
|
18 |
On considère la réaction entre l’acide A1H (du couple A1H / A1–, KA1) et la base A2– (du couple A2H / A2–, KA2 ). Il se produit la réaction chimique : A1H (aq) + A2– (aq) =
A1–
(aq) + A2H
(aq) À cette réaction est associée une constante d’équilibre K d’expression : |
|
|
|
A |
|
19 |
Une solution de chlorure d’ammonium a un pH = 11. Le pKA du couple NH4+ (aq) / NH3 (aq) vaut 9,2. Dans cette solution : |
L’espèce prédominante est NH3 (aq) |
L’espèce prédominante est l’ion ammonium NH4+ (aq) |
Il n’y a pas d’ions ammonium |
A |
|
20 |
Une solution de soude de formule {Na+ (aq) + HO– (aq)}a une concentration en ions hydroxyde de 1,0 × 10 – 5 mol / L. Son pH, à 25 ° C, vaut : |
pH ≈ 5,0 |
pH ≈ 9,0 |
pH ≈ 7,0 |
B |
- Autoprotolyse de l’eau.
-
A
25 °C , l’eau pure a un pH = 7. En
conséquence, l’eau pure contient des ions oxonium H3O+.
- La concentration des ions oxonium peut se déduire de la définition du pH d’une solution aqueuse diluée :
- [H3O+ ]eq =10 – pH ⇒ [H3O+ ]eq ≈ 1,0 × 10 – 7 mol / L
- L’eau pure est partiellement ionisée.
- Il se produit une réaction acido-basique entre deux molécules d’eau.
- Il y a un échange de protons entre deux molécules d’eau.
- H2O (ℓ) + H2O (ℓ) = H3O+ (aq) + HO– (aq) (1)
- La réaction d’autoprotolyse de l’eau est une réaction très limitée.
- Seulement 2 molécules d'eau sur 556 millions participent à la formation des ions :
Avancement
final de la réaction d’autoprotolyse de l’eau.
-
À
25 °C , un volume V =
1,00 L d’eau a un pH = 7,0.
- On peut dresser le tableau d’avancement de la réaction et déterminer la valeur du taux d’avancement final de la réaction.
- Dans 1,00 L d’eau, il y a environ 55,6 mol d’eau.
- Tableau d’avancement de la réaction d’autoprotolyse de l’eau :
|
Équation |
2 H2O
(ℓ)
|
= |
H3O+
(aq)
|
+
HO
–
(aq) |
|
|
état |
Avancement
x
(mol) |
(mol) |
|
(mol) |
(mol) |
|
État initial
(mol) |
0 |
ni
= 55,6 |
|
0 |
0 |
|
Au cours
Trans. |
x |
ni
–
2 x |
x |
x |
|
|
Avancement
final |
xf |
ni
–
2 xf |
xf |
xf |
|
|
Avancement
maximal |
xmax |
ni
–
2 xmax = 0 |
xmax |
xmax |
|
-
Taux d’avancement final de la
réaction :
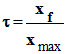
- Expression de l’avancement final : On connaît la valeur du pH de la solution. En conséquence :
- xf = [H3O+ ] (eq) . V
-
Par définition :
[H3O+ ]
=10 –
pH mol / L
-
On en déduit que : xf
=
10 –
pH . V
- xf ≈ 1,0 × 10 – 7 x 1,0
- xf ≈ 1,0 × 10 – 7 mol
- Taux d’avancement final :
-
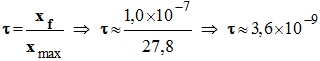
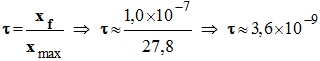
|
Équation |
2 H2O
(ℓ)
|
= |
H3O+
(aq)
|
+
HO
–
(aq) |
|
|
état |
Avancement
x
(mol) |
(mol) |
|
(mol) |
(mol) |
|
État initial
(mol) |
0 |
ni
= 55,6 |
|
0 |
0 |
|
Avancement
final |
xf |
neq
≈ 55,6 |
xf ≈ 1,0 × 10 – 7
|
xf ≈
1,0
× 10
– 7 |
|
- La constante d’équilibre associée à l’équation d’autoprotolyse de l’eau, notée K e est appelée produit ionique de l’eau.
-
Ke
= [ H3O+ ]eq
.
[HO
–]eq
- La valeur du produit ionique de l’eau dépend de la température. Elle croît avec la température.
- Remarque : pour des raisons de commodité, on utilise le pKe.
-
pKe
=
- log Ke
⇒
Ke
= 10 – pKe à
25 °C , pKe
≈
14.
Les
solutions aqueuses et le produit ionique de l’eau.
- Dans toutes les solutions aqueuses, le produit ionique de l’eau vaut : Ke = [H3O+ ]eq . [HO –]eq
- En utilisant le pK e, on peut écrire :
-
pKe
=
- log [H3O+ ]eq
- log [HO –]eq
⇒
pKe.= pH
- log [HO –]eq
Solutions
neutre, acide, basique.
- Une solution neutre contient autant d'ions oxonium que d'ions hydroxyde.
-
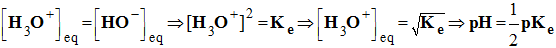
- À 25° C, pKe = 14 et pH = 7 pour les solutions neutres.
- Une solution acide contient plus d'ions oxonium que d'ions hydroxyde
-
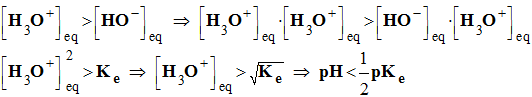
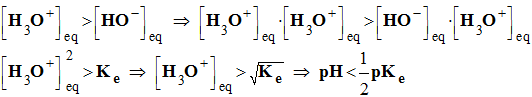
- À 25° C, pKe = 14 et pH < 7 pour les solutions acides.
- Une solution basique contient plus d'ions hydroxyde que d'ions oxonium :
-
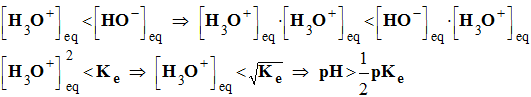
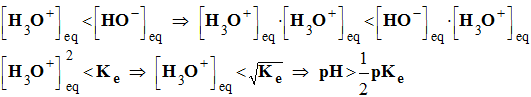
- À 25° C, pKe = 14 et pH > 7 pour les solutions basiques.
- L’équation de la réaction entre un acide AH et l’eau s’écrit :
-
AH
(aq)
+ H2O
(ℓ) =
H3O+ (aq)
+ A–
(aq)
(1)
- cette réaction fait intervenir les couples acide / base suivants : AH (aq) / A– (aq) et H3O+ (aq) / H2O (ℓ).
- La constante d’équilibre associée à cette réaction est appelée constante d’acidité notée KA.
-
Expression :
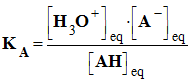 constante
d’acidité du couple : AH (aq) / A–
(aq)
constante
d’acidité du couple : AH (aq) / A–
(aq)
- Remarque 1 : La constante d’acidité dépend de la température.
-
Remarque 2 : On peut utiliser la
pK A.
-
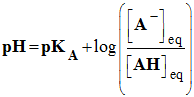
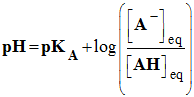
- généralisation : Pour tout couple Acide / Base, noté A / B tel que :
-
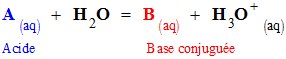
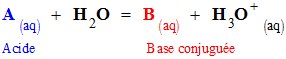
-
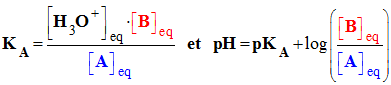
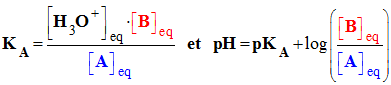
Comportement
des acides en solution aqueuse.
- Pour des solutions aqueuses d’acides de mêmes concentrations :
- Le pH est d’autant plus faible que le KA est grand ou le pKA petit.
- Le taux d’avancement final est d’autant plus grand que le KA est grand ou le pKA petit.
- L’acide est d’autant plus dissocié que le KA est grand ou le pKA petit.
Comportement
des bases en solution aqueuse.
- Pour des solutions aqueuses de bases de mêmes concentrations :
- Le pH est d’autant plus élevé que le KA est petit ou le pKA grand.
- Le taux d’avancement final est d’autant plus grand que le KA est petit ou le pKA grand.
- La base est d’autant plus dissociée que le KA est petit ou le pKA grand.
Constante
d’équilibre K des réactions acido-basiques.
- Relation entre K et les constantes d’acidité des couples acide / base.
- On considère la réaction entre l’acide A1H (du couple A1H / A1– , KA1) et la base A2– (du couple A2H / A2–, KA2 )
- Il se produit la réaction chimique :
-
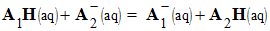
- A chaque couple est associé une constante d’acidité :
-
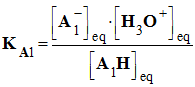
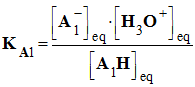
-
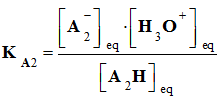
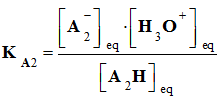
- La réaction entre l’acide A1H et la base A2– est caractérisée par une constante d’équilibre K :
-
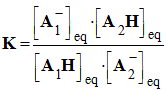
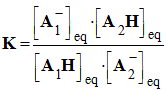
- On peut exprimer K en fonction de KA1 et KA2.
-
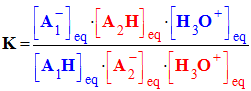
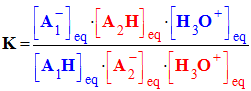
-
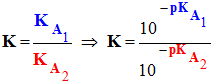
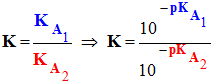
-
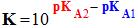
- La constante l’équilibre de la réaction dépend des constantes d’acidité des couples acide / base mis en jeu.
Diagramme
de distribution et domaines de prédominance.
- Cas général.
- La relation :
-
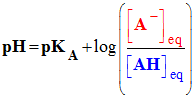
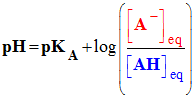
- qui découle de la réaction :
- Si pH = pKA, L'acide AH est la base conjuguée A– ont les mêmes concentrations
- Si pH > pKA, La base A– est l'espèce prédominante
- Si pH < pKA, L’acide AH est l'espèce prédominante
- représentation sur un axe horizontal : couple AH / A –.
- Diagramme de distribution : pour l’acide éthanoïque (pKA = 4,8)
|
|