|
QCM N° 03 |
pH, Acides et bases, réactions acido-basiques, Avancement final d'une réaction Cours : 2010 Cours : 2004 Cours : 2018 |
|
|
|
pH, Acides et bases, réactions acidobasiques avancement final d'une réaction Pour chaque question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Les propriétés acides et basiques des solutions aqueuses : |
Dépendent de la concentration en ions hydroxyde HO– |
Dépendent de la concentration en ions oxonium H3O+ |
Dépendent de la quantité d’eau |
AB |
|
2 |
La relation suivante : pH = – log [H3O+] est valable : |
Quelle que soit la concentration C de la solution |
Pour les solutions diluées, C ≤ 2,0 × 10–2 mol / L |
Pour les solutions de concentration, C ≤ 1,0 mol / L |
B |
|
3 |
La relation : pH = – log [H3O+] est équivalente à : |
[H3O+] = 10– pH mol / L |
[H3O+] = 10 pH mol / L |
[H3O+] = e– pH mol / L |
A |
|
4 |
Pour mesurer le pH d’une solution avec précision, on utilise : |
Le papier pH |
Des indicateurs colorés |
Le pH-mètre |
C |
|
5 |
Le pH-mètre est : |
Un voltmètre électronique |
Constitué d’une sonde reliée à un voltmètre électronique |
Un appareil qui mesure la concentration en ions oxonium d’une solution |
B |
|
6 |
Pour effectuer une mesure de pH avec un pH-mètre, il faut : |
Plonger la sonde dans la solution, mettre le commutateur sur la position pH et effectuer la lecture |
Étalonner le pH-mètre |
Une solution acide |
B |
|
|
|
||||
|
7 |
On effectue la mesure du pH d’une solution aqueuse. Après agitation et stabilisation, on obtient la valeur du pH indiquée sur la photo ci-dessus. La valeur de la concentration en ions oxonium vaut : |
[H3O+] ≈ 1,3 × 10– 4 mol/L |
[H3O+] ≈ 1,26 × 10– 4 mol/L |
[H3O+] ≈ 1,0 × 10 –3,90 mol/L |
A |
|
8 |
Selon Bronsted, un acide est une espèce chimique capable : |
De capter au moins un proton H+ |
De céder au moins un proton H+ |
De céder au moins un électron e– |
B |
|
9 |
Selon Bronsted, une base est une espèce chimique capable : |
De capter au moins un proton H+ |
De céder au moins un proton H+ |
De céder au moins un électron e– |
A |
|
10 |
Une base est : |
Toujours une molécule |
Toujours un ion |
Une molécule ou un ion |
C |
|
11 |
Un acide est : |
Toujours une molécule |
Toujours un ion |
Une molécule ou un ion |
C |
|
12 |
L’ion hydroxyde HO– est la base conjuguée de : |
H3O+ |
H2O |
H2O2 |
B |
|
13 |
L’ion H3O+ est l’acide conjugué de : |
H2O |
HO– |
H2O2 |
A |
|
14 |
L’eau est une espèce amphotère, on parle d’ampholyte. Elle peut se comporter : |
En tant qu’acide eulement |
En tant que base seulement |
En tant qu’acide ou en tant que base |
C |
|
15 |
Une réaction acido-basique est caractérisée par : |
Un transfert d’électron de l’acide d’un couple acide / base vers la base d’un autre couple acide / base |
Un transfert de proton de la base d’un couple acide / base vers l’acide d’un autre couple acide / base |
Un transfert de proton de l’acide d’un couple acide / base vers la base d’un autre couple acide / base |
C |
|
16 |
Dans une fiole jaugée de volume V = 500,0 mL, partiellement remplie d’eau distillée, on verse avec précaution mapp = 3,00 g d’acide éthanoïque. On mélange puis on complète avec de l’eau distillée jusqu’au trait de jauge et on mélange. Donnée : masse molaire de l’acide éthanoïque : M = 60,05
g / mol La valeur de l’avancement maximal xmax de la réaction entre l’acide éthanoïque et l’eau vaut : |
xmax ≈ 5,00 × 10– 2 mol |
xmax = 3,00 g |
xmax ≈ 5,00 × 10– 2 mol / L |
A |
|
17 |
Le pH de la solution précédente vaut 2,90. L’avancement final xf de la réaction entre l’acide éthanoïque et l’eau vaut : |
xf ≈ xmax |
xf ≈ 1,3 × 10– 2 mol |
xf ≈ 6,3 × 10 –4 mol |
C |
|
18 |
L’avancement d’une réaction est toujours : |
0 ≤ x < 1 |
0 ≤ x < xmax |
0 ≤ x ≤ xf |
C |
|
19 |
L’avancement final d’une réaction est toujours : |
0 ≤ xf < 1 |
0 ≤ xf ≤ xmax |
0 ≤ xf < xmax |
B |
|
20 |
Une solution d’acide éthanoïque de concentration C = 5,0 × 10– 4 mol / L a un pH = 4,5. L’avancement final de la réaction de l’acide éthanoïque sur l’eau : |
Est égal à l’avancement maximal |
Est supérieur à l’avancement maximal |
Est inférieur à l’avancement maximal |
C |
|
21 |
Le taux d’avancement d’une réaction est égal : |
Au quotient de l’avancement final sur l’avancement maximal |
Au produit de l’avancement final par l’avancement maximal |
Au quotient de l’avancement maximal sur l’avancement final |
A |
-
Les propriétés acides et basiques des solutions
aqueuses dépendent de la concentration en ions oxonium H3O+.
-
Remarque : comme pour toutes les solutions
aqueuses : [H3O+] . [HO –]
= Ke
-
Les concentrations en ions hydroxyde et en ions
oxonium ne sont pas indépendantes. Elles dépendent l’une de
l’autre.
-
Quand [H3O+] ↑,
alors [HO –] ↓ et inversement.
-
On admet, pour les solutions diluées, C ≤
2,0
× 10 –2 mol / L, les relations suivantes :
-
pH = – log [H3O+]
-
pH = – log [H3O+]
-
Cette relation est équivalente à :
-
[H3O+] = 10 –
pH mol / L
-
Les indicateurs colorés :
-
Comme indicateurs colorés, on utilise,
l'hélianthine, le bleu de bromothymol et la phénolphtaléine.
-
L'utilisation des indicateurs colorés permet de
déterminer un encadrement de la valeur du pH d'une
solution.
-
Le papier pH :
-
Le papier pH est imbibé d'un mélange de
plusieurs indicateurs colorés, il peut donner une valeur du
pH à 0,5 unité près.
-
Le pH-mètre :
-
Dans les conditions habituelles, au lycée, on peut
mesurer un pH, au mieux, à 0,05 unité près (Le plus
souvent à 0,1 unité près).
-
Il est constitué d’une sonde de mesure reliée à un
voltmètre électronique.
-
La sonde de mesure est constituée d’une électrode
de verre et d’une électrode de référence (les deux électrodes
peuvent être combinées ou séparées).
-
Il est nécessaire d’étalonner le pH-mètre avant
toute mesure.
-
L’étalonnage du pH-mètre nécessite l’utilisation
de deux solutions étalons de pH connu.
-
Mesure du pH : pour effectuer la mesure du
pH d’une solution aqueuse, la sonde doit être rincée à
l’eau distillée, essuyée puis plongée dans la solution étudiée.
-
Après agitation et stabilisation de la mesure, la
valeur du pH est relevée.
La mesure du pH et sa précision
-
Dans les conditions habituelles, au lycée, on peut
mesurer un pH, au mieux, à 0,05 unité près (Le plus
souvent à 0,1 unité près).
-
Conséquence :
-
Une mesure de pH effectuée à 0,05 unité
près conduit à une valeur de la concentration en ion oxonium [H3O+] connue à 11,5 % près.
-
Une simple mesure de pH ne peut donner une
concentration avec précision.
-
Il faut limiter le nombre de chiffres
significatifs pour représenter une concentration déduite de la
valeur du pH.
-
Toute concentration déduite de la valeur du pH
sera exprimée avec 2 chiffres significatifs au maximum.
-
Dans le cas présent, pH = 3,90
-
[H3O +] ≈ 1,0
× 10 – 3,90 mol / L
-
Or à la calculatrice : 10 – 3,90 ≈
1,25892541179
× 10 – 4
-
Le résultat avec deux chiffres significatif :
-
[H3O +] ≈ 1,3
× 10 – 4 mol / L
-
Un acide est une espèce chimique capable de céder
au moins un proton H+.
-
On écrit : AH = H+ + A –
-
Une base est une espèce chimique capable de capter
au moins un proton
-
On écrit : A – + H+ = AH
-
Exemples : HCl = H+ + Cl –
-
CH3COOH =
H+ + CH3COO
–
-
NH4+ =
H+ + NH3
-
L’espèce chimique A– donne
l’acide AH en captant un proton H+.
-
On dit que A– est la base
conjuguée de l’acide AH.
-
On parle du couple acide / base : AH / A
–.
-
Exemples : AH = H+ + A – couple
AH / A –
-
B + H+
= BH + couple
BH+ / B
-
Dans le cas présent :
-
Couple 1: H2O / HO–
-
Couple 2 : H3O+
/ H2O
-
Une réaction acido-basique consiste à un transfert
d'un proton entre l’acide A1H d’un couple sur
la base A2- d’un autre
couple.
-
Couple acide / base 1 : A1H
= H+ + A1–
-
Couple acide / base 2 : A2H
= H+ + A2–
-
Équation de la réaction : On se place dans le cas
ou l’acide A1H réagit sur la base A2–
A1H + A2– = A1– + A2H
-
cette
réaction met en jeu les couples acide / base suivants : A1H
/ A1– et A2H /
A2–
Avancement maximal et avancement final.
-
Couple acide éthanoïque / ion éthanoate : CH3COOH
(aq) / CH3COO–(aq)
-
Lors de la réaction acido-basique,
-
Il y a un transfert d'un proton :
-
De l’acide du couple CH3COOH
(aq) / CH3COO –
(aq) vers la base du couple H3O+
(aq) / H2O (ℓ).
-
Équation de la réaction :
CH3COOH (aq) + H2O (ℓ) = CH3COO – (aq) + H3O+ (aq)
-
écriture
qui correspond à l’état actuel de nos connaissances.
-
Le soluté apporté est l’acide éthanoïque pur.
L’eau constituant majoritaire est le solvant.
-
En conséquence, l’eau est en large excès. Le
soluté est le réactif limitant de la réaction.
-
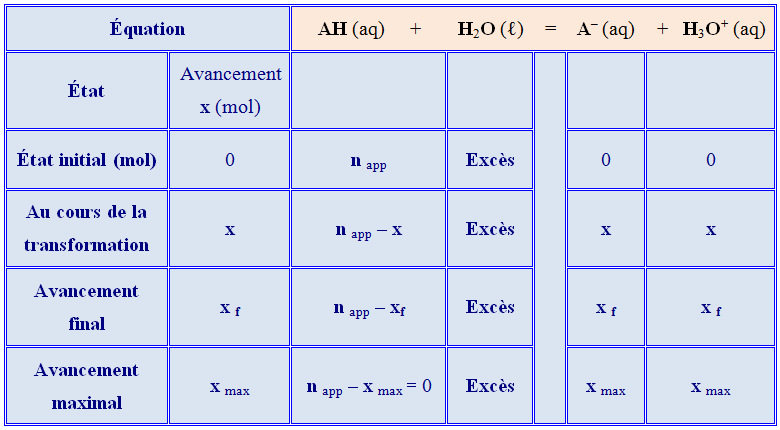
Tableau d’avancement :
-
Détermination de x max.
-
On utilise la relation du tableau d'avancement :
-
n
app - x
max = 0
-


-
La valeur du pH de la solution permet de
calculer la concentration en ions oxonium de la solution et d’en
déduire la quantité de matière d’ions oxonium présents dans la
solution en fin de réaction.
-
Concentration finale en ions oxonium :
-
[H3O +]f
= 10
–pH
mol / L
-
[H3O +]f
= 10 –2,90
mol / L
-
[H3O +]f ≈
1,3
× 10
–2 mol / L
-
Du tableau d’avancement de la réaction, on peut
déduire que :
-
xf = nf
(H3O +) = [H3O+]f . V = 10–
pH . V
-
xf = 10– 2,90
× 0,500
-
xf ≈ 6,3
× 10– 4 mol
-
Comparaison :
-
napp = x max
≈ 5,00
× 10 – 2 mol et xf
≈ 6,3
× 10 – 4 mol
-
xf < x
max
-
La réaction entre l’acide éthanoïque et l’eau
n’est pas totale.
Taux d’avancement d’une réaction
-
Une transformation chimique n’est pas toujours
totale.
-
Dans ce cas, aucun des réactifs n’a totalement
disparu lorsque le système cesse d’évoluer.
-
L’avancement final est inférieur à l’avancement
maximal.
-
Pour pouvoir rendre compte de ce phénomène, on
définit une nouvelle grandeur : le taux d’avancement d’une
réaction.
-
Le taux d’avancement d’une réaction, noté τ, est
le rapport entre son avancement final et son avancement maximal.
-


-
Si τ = 0, la réaction n’a pas lieu.
-
Si τ = 1, la réaction est totale et si 0 <
τ < 1, la réaction conduit à un équilibre chimique.
-
On peut exprimer cette grandeur en pourcentage
-
Le taux d’avancement final dépend de la nature et
de la concentration de l’acide.
|
|