|
QCM N° 03 |
Vu au Collége Le sport |
|
|
|
|
QCM N° 03
Vu au Collège : Le sport.
Pour chaque question,
indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
À la pression atmosphérique normale, le passage de l’eau à l’état
gazeux :
|
est une
vaporisation. |
s’accompagne d’une élévation
de température. |
s’effectue
à 100 ° C. |
AC |
|
|
Au cours du changement d’état d’un corps constitué de molécules : |
la masse reste la
même. |
le volume reste le
même. |
la nature des molécules
reste inchangée. |
AC |
|
|
Au cours d’une réaction chimique : |
la masse reste la
même. |
le volume reste le même. |
les produits s ont transformés
en réactifs. |
A |
|
|
L’équation de la réaction chimique suivante
C
+
O2
→
CO2 traduit : |
le changement de nature
des atomes. |
la consommation de carbone, C et de dioxygène, O2 et la formation de dioxyde de carbone,
CO2. |
la conservation du nombre
d’atomes. |
BC |
|
|
L’énergie est une grandeur physique qui s’exprime en |
watt (W). |
joule (J). |
volt (V). |
B |
|
|
L’air enfermé dans un ballon :
|
a une
masse. |
n’occupe pas toujours le même
volume. |
est composé en majorité
de diazote. |
ABC |
|
|
Lors
d’une combustion :
|
du dioxygène
est
consommé. |
de l’énergie est
consommée. |
des produits
se forment. |
AC |
|
|
La lumière se propage dans le vide à 300000 km / s. Le Soleil est à 150000000 km de la Terre. Pour atteindre la Terre, la lumière émise par le Soleil met : |
45
× 1012
s |
500 s |
0,002 s |
B |
|
|
Le poids d’un objet sur Terre est dû : |
à l’action attractive qu’exerce la Terre sur
cet objet. |
à la pression
atmosphérique. |
à son énergie
cinétique. |
A |
|
|
La pression d’un gaz se mesure : |
en newton
(N). |
en pascal
(Pa). |
avec un
manomètre. |
BC |
|
|
1)-
Changements d’état physique.
2)-
Changement d’état et corps pur moléculaire. |
1)-
Changements d’état physique.
(Leçon) 
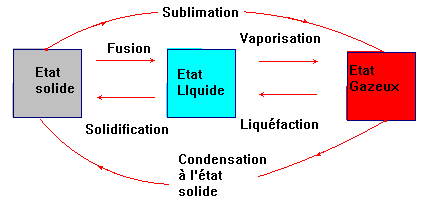
-
La vaporisation est le passage de l’état
liquide à l’état solide.
-
Pour les corps purs un changement d’état
s’effectue à température constante, la température de changement d’état.
-
Ainsi, pour l’eau la vaporisation ou la
liquéfaction de d’eau s’effectue à la température d’ébullition
θéb
= 100 ° C sous la pression atmosphérique.
►
Diagramme d’état de l’eau :
-
Point triple de
l’eau :
-
Point du diagramme d’état de l’eau où
coexistent les trois états : solide, liquide et gazeux de l’eau.
-
La pression P = 6,15 mbar
-
La température
θ
= 0,010 ° C)
►
Remarque :
-
La température d’ébullition de l’eau dépend
de la pression.
-
Si la pression augmente, la température
d’ébullition de l’eau augmente.
-
Ainsi pour une pression P = 5,0 bar,
la température d’ébullition
θéb
= 150 ° C (voir l’exploitation graphique suivante)
-
Pour une pression P = 123 mbar, la
température d’ébullition
θéb
= 50 ° C
-
Unités : 1 bar
≈
0,987 atm
≈
1,00
x105 Pa = 1000 hPa et 1 atm
≈1013
hPa
2)-
Changement d’état et corps pur moléculaire.
(Leçon) 
-
L’énergie thermique apportée à un corps pur
moléculaire peut :
-
Provoquer une augmentation de la température
avec rupture des interactions intermoléculaires et accroissement de
l’agitation des molécules
-
Provoquer un changement d’état physique avec
seulement rupture d’interaction intermoléculaires, la température restant
constante.
-
Le changement d’état d’un corps pur,
initialement liquide, en gaz nécessite un apport d’énergie.
-
Au cours d’un changement d’état physique,
d’un composé moléculaire, il y a seulement rupture
d’interaction intermoléculaires, la température restant constante.
-
Les molécules ne sont pas affectées.
-
Si on chauffe un kilogramme d’eau à l’état
solide, on obtiendra un kilogramme d’eau à l’état liquide, puis un
kilogramme d’eau à l’état gazeux.
►
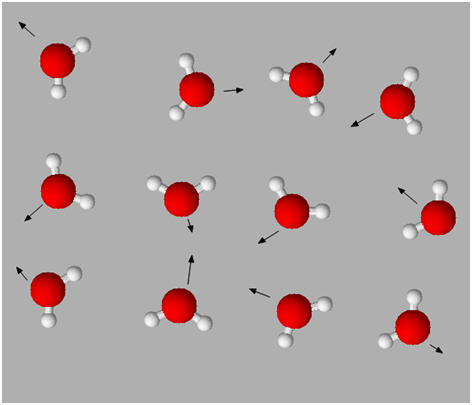
Les états de la matière.
-
L’état gazeux :
-
L’état gazeux est un état dispersé et
désordonné.
-
Les molécules et les ions sont éloignés les
uns des autres et se déplacent dans toutes les directions de façon
désordonnée.
-
Les interactions entre les entités chimiques
sont faibles.
-
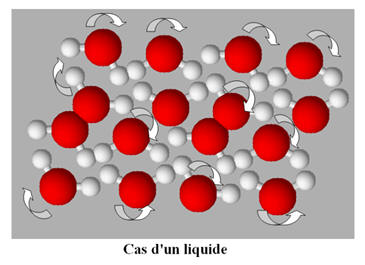
L’état liquide :
-
L’état liquide est un état condensé et
désordonné.
-
À l’état liquide, les entités chimiques sont
les unes contre les autres et peuvent glisser les unes sur les autres.
-
Les entités chimiques sont en mouvement
constant.
-
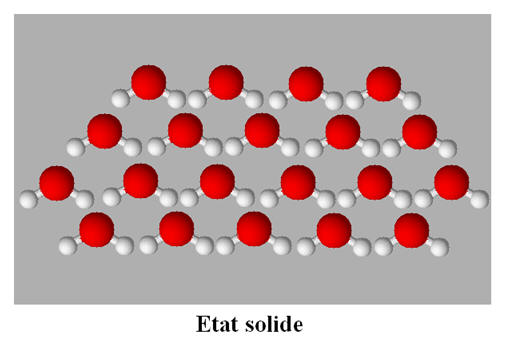
L’état solide :
-
L’état solide est un état condensé et
ordonné.
-
Les particules dans la matière condensée sont
soumises à des interactions attractives qui les maintiennent en contact les
unes avec les autres, tandis que les interactions répulsives leur imposent
des structures d’empilement.
-
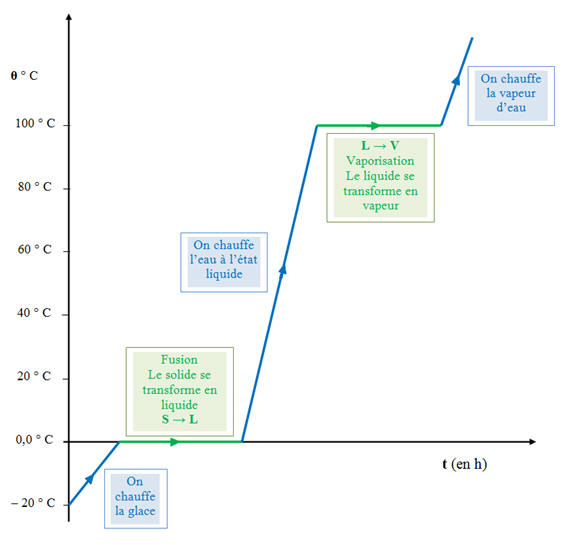
Diagramme :
On chauffe un morceau de glace pris à
- 20
°C :
-
un
transfert d'énergie sous forme de chaleur modifie l'énergie microscopique du
système.
3)-
La réaction chimique :

a)-
Transformation chimique ou réaction chimique.
-
Une transformation chimique a lieu chaque
fois qu’une nouvelle espèce chimique apparaît ou chaque fois qu’une nouvelle
espèce chimique disparaît.
-
Au cours d’une transformation chimique : les
espèces chimiques qui disparaissent sont appelées les
réactifs et les espèces chimiques qui apparaissent sont appelées
les produits.
-
On appelle
état
initial (E.I) du
système chimique, l’état de ce système avant la transformation chimique.
-
On appelle
état
final (E.F) du
système chimique, l’état de ce système lorsque la transformation chimique
est terminée.
-
La transformation chimique permet le passage
de l’état initial à l’état final.
b)-
Exemple 2 : Réaction entre la soude et la
solution de sulfate de cuivre II.
|
État initial |
Transformation chimique |
État final |
|
Solution aqueuse de sulfate de cuivre II : (Cu2+
(aq) + SO4 2– (aq)
) Solution
aqueuse de soude : (Na+
(aq) + HO – (aq)
) quantités de matière : n (Cu2+), n (SO4 2–), n (Na+), n
(HO –), température
et pression : p
et θ |
Action de la soude sur la solution aqueuse de sulfate de cuivre
II |
Précipité bleu d’hydroxyde de cuivre II : Cu(OH)2
(s)
et la solution bleue : (Cu2+
(aq) + SO4 2– (aq)
)
et (Na+
(aq) + HO – (aq)
) ? quantités de matière : n (Cu(OH)2), n (Cu2+), n (SO4
2–), n
(Na+), n (HO –) ? température
et pression : p
et θ |
c)-
Conclusion :
- Lorsque l’évolution d’un système chimique s’accompagne de l’apparition de nouvelles espèces chimiques, le passage de l’état initial à l’état final est une transformation
chimique.
4)-
Équation chimique :

a)-
Lois de conservation.
-
Conservation des éléments chimiques :
-
Au cours d’une réaction chimique, il y a
conservation des éléments chimiques.
-
Les éléments présents dans les réactifs se
retrouvent dans les produits.
-
Conservation de la charge : au cours d’une
réaction chimique, la charge se conserve.
- Conservation de la masse : (Lavoisier) :
- le
chimiste français Lavoisier a montré que la masse des réactifs qui
disparaissent est égale à la masse des produits qui apparaissent.
b)-
L’équation chimique :
-
L’équation chimique est l’écriture
symbolique d’une réaction chimique.
-
Par convention :
-
On écrit les formules des réactifs dans le
membre gauche de l’équation chimique
-
On écrit les formules des produits dans le
membre droit de l’équation chimique.
-
On sépare les deux membres de l’équation par
une flèche.
|
Réactifs |
Transformation chimique |
Produits |
|
(
… )
+ (
… ) |
→ |
(
… )
+ (
… ) |
c)-
Ajustement des nombres stœchiométriques.
-
Ajuster les nombres stœchiométriques d’une
équation, c’est choisir ces nombres de manière à traduire la conservation de
tous les éléments mis en œuvre.
-
Par convention, le nombre stœchiométrique se
place devant la formule de l’espèce chimique.
-
Le nombre stœchiométrique 1 ne s’écrit pas
d)-
Exemple :
-
Le butane brûle dans le dioxygène pour donner
du dioxyde de carbone et de l’eau
-
Tableau :
|
|
Réactifs |
|
Produits |
|
Équation
chimique |
2
C4H10
(g) +
13
O2 (g) |
→ |
8
CO2 (g)
+
10
H2O
(ℓ) |
|
Éléments chimiques
présents |
Carbone
C, hydrogène
H, et oxygène
O. |
||
|
Nombre de
« carbone » |
2
× 4 = 8 |
|
8
× 1 = 8 |
|
Nombre
d’ « hydrogène » |
2
× 10 = 20 |
|
10
× 2 =
20 |
|
Nombre
d’ « oxygène » |
13
× 2 = 26 |
|
8
× 2 + 10
× 1
= 26 |
-
Le sulfate de cuivre II réagit avec la
soude en donnant un précipité bleu d’hydroxyde de cuivre II.
|
|
Réactifs |
|
Produit |
|
Équation
chimique |
(Cu2+
(aq) +
2 HO –
(aq) ) |
→ |
Cu(OH)2
(s) |
|
Éléments chimiques
présents |
Carbone
Cu, hydrogène
H, et oxygène
O. |
||
|
Nombre de
« cuivre » |
1
× 1 = 1 |
|
1
× 1 = 1 |
|
Nombre
d’ « hydrogène » |
2
× 1 = 2 |
|
1
× 2 =
2 |
|
Nombre
d’ « oxygène » |
2
× 1 = 2 |
|
1
× 2 = 2 |
|
Charge |
1
×
(2+)
+ 2
×
(1-) = 0 |
|
0 |
5)-
L’énergie : (Leçon)
a)-
Introduction.
-
Tout ce qui vie fonctionne, évolue, nécessite
de l'énergie.
-
Le concept d'énergie est un concept abstrait,
très récent qui est employé aujourd'hui dans des domaines très variés qui
dépassent le cadre de la mécanique classique.
- Dans la vie de tous les jours, on entend parler de différents types d'énergie :
- l'énergie électrique, l'énergie calorifique, l'énergie lumineuse,
l'énergie mécanique. En conséquence, il existe différents types d'énergie.
- D'autre part, on sait transformer une énergie en d'autres types énergies :
- l'énergie électrique peut être convertie en
énergie lumineuse, en énergie calorifique, en énergie mécanique suivant le
convertisseur utilisé.
b)-
Une définition :
-
Un système possède de l'énergie s'il est
capable de produire des transformations telles que :
-
Élever la température d'un corps
-
Allumer une lampe
-
Mettre un objet en mouvement…. etc.
c)-
Les sources d'énergie.
-
Les sources fossiles : charbon,
pétrole et gaz naturel
-
Les sources nucléaires : la principale
est l'uranium : l'oxyde d'uranium U2O.
- Les sources renouvelables :
- le soleil (il est à l'origine de presque toutes les sources d'énergie sur terre),
- le vent (énergie éolienne),
- la géothermie (utilisation des réserves d'eau chaude :
- sous terre, la température augmente environ de 1°C lorsque l'on s'enfonce de 30 m ),
- la biomasse (la matière vivante végétale et animale est susceptible de fournir de l'énergie :
- aliments, le bois, la fermentation).
d)-
Unités d'énergie.
-
L'unité légale d'énergie est le joule
J. On utilise le kiloJoule et le mégajoule :
-
1 kJ = 1000 J et 1MJ = 106
J.
-
équivalences
:
-
La tonne équivalent pétrole : énergie
libérée par la combustion d'une tonne de pétrole :
-
1 t.e.p = 4,2
× 10
10
J
-
la
tonne équivalent charbon : énergie libérée par la combustion d'une tonne
de charbon :
-
1 t.e.c = 0,69 t.e.p
-
Le kilowatt. heure : énergie consommée
par une machine de puissance 1000 watts qui fonctionne pendant une heure.
-
1 kW.h = 3,6
× 10
6
J
-
L'électron-volt : énergie acquise par
une particule chargée de charge égale à la charge élémentaire accélérée par
une différence de potentiel de un volt.
-
1 eV = 1,6
× 10
– 19
J
-
On utilise aussi le mégaélectron-volt (MeV)
et le gigaélectron-volt (GeV).
6)-
L’air :
-
L’air est un mélange, constitué en volume,
d’environ 80 % de diazote, N2 et de 20 % de dioxygène,
O2.
-
L’air est donc un mélange de gaz dans les
conditions normales.
-
La masse d’un litre d’air est d’environ 1,29
g à 0 ° C sous la pression atmosphérique (P = 1,013 hPa).
-
L’air peut être comprimé, détendu comme tous
gaz.
-
On peut obtenir de l’air liquide.
7)-
La Combustion :
-
Une combustion nécessite un combustible et un
comburant (le plus souvent le dioxygène de l’air).
-
Une combustion est une transformation
chimique.
-
Exemple : combustion complète du butane :
2 C4H10
(g) + 13 O2 (g) →
8 CO2 (g) + 10 H2O
(g)
-
La réaction de combustion nécessite du
dioxygène.
-
Elle produit du dioxyde de carbone et de la
vapeur d’eau.
- Lorsque l’apport en dioxygène est insuffisant, la combustion devient incomplète et d’autres espèces chimiques peuvent se former :
- le carbone C (fine poudre noire)
-
Ou le monoxyde de carbone CO (gaz
toxique).
-
Énergie libérée lors de la combustion : une
combustion fournit de l’énergie thermique.
-
Les énergies thermiques molaires sont de
l’ordre de 103 à 104 kJ / mol.
8)-
Vitesse de la lumière.
-
La lumière se propage en ligne droite dans
tout milieu transparent homogène (comme l’air, l’eau et le vide).
- En 1674, étudiant les éclipses de la planète Jupiter sur son satellite Io,
- Le Danois Römer donne une première estimation
de la vitesse de la lumière dans le vide.
-
La valeur fixée pour la vitesse de
propagation de la lumière dans le vide est :
-
c = 2,997924558
× 108 m / s
- C’est une constante Universelle. Cette vitesse est une vitesse limite.
- Aucun objet matériel ne peut atteindre cette vitesse dans le vide.
- En pratique, on donne à cette vitesse une valeur
approchée :
-
c
≈
3,00
× 108 m / s
- Dans les milieux transparents, la lumière se déplace moins vite que dans le vide.
- La vitesse de la lumière dans l’air est
peu différente de celle dans le vide.
-
cair
≈
3,00
× 108 m / s
-
Durée
Δt
mise par la lumière pour parcourir la distance
Soleil – Terre :
-
Données : dT-S = 150000000
km et c = 300000 km / s
-
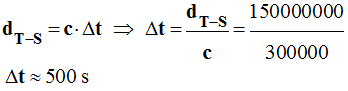
9)-
Poids d’un objet sur Terre :

-
Le poids d’un corps situé au voisinage de la
Terre est assimilé à la force d’attraction gravitationnelle que la Terre
exerce sur ce corps.
-
L’action exercée par la Terre sur les corps
proches de la surface se nomme la pesanteur.
-
Sur la terre, tout corps de masse
m
est soumis à une force appelée poids du corps :
-
Le poids d’un objet sur Terre est
pratiquement égal à la force gravitationnelle exercée par la Terre sur
l’objet.
-
Remarque :
-
La différence entre le poids d’un objet sur
la Terre et la force de gravitation exercée par la Terre sur l’objet
provient de la rotation de la Terre sur elle-même.
-
Le poids d’un corps peut s’identifier à la
force gravitationnelle exercée par la Terre sur l’objet.
-
La valeur du poids varie en fonction de la
latitude et de l’altitude.
-
Expression du poids : P =
m.g.
|
Grandeur physique |
Unité |
|
Poids
P |
newton
(N) |
|
masse
m |
kilogramme
(kg) |
|
facteur d’attraction
terrestre
g
= 9,8 N / kg. |
newton par kilogramme
(N
/ kg)
|
10)-
Pression d’un gaz.
a)-
La pression :

-
La valeur
F de la force pressante
exercée par un fluide sur une paroi de surface
S dépend de la pression
P du fluide.
-
Par définition la pression
P d’un fluide est donnée par
la relation :
-


b)-
unité
légale de pression.
-
Par définition, l’unité légale de pression
est le pascal de symbole Pa.
-
C’est la pression exercée par une force
pressante de 1 N sur une surface plane de 1 m2.
-
On emploie couramment d’autres unités :
-
Le bar
(bar) : 1 bar = 105 Pa
-
L’hectopascal : 1 hPa = 102 Pa = 1
mbar
c)-
Mesure de la pression d’un gaz.
►
Le manomètre.
-
Les manomètres utilisent comme principe de
fonctionnement :
-
La déformation d’une paroi métallique.

|
|