|
Transformations physiques Cours |
|
|
|
|
|
|
1)- Énergie massique de changement
d’état :
2)- Chaleur latente de changement
d’état :
4
|
|
1)- Exercice 3 page 104 2)- Exercice 6 page 104 : 3)- Exercice 7 page 104 : 4)- Exercice 8 page 104 : 5)- Exercice 10 page 105 : 6)- Exercice 11 page 105 :
7)- Exercice 12 page 105 : 8)- Exercice 14 page 105 : 9)- Exercice 23 page 108 : |
|
Transformations physiques |
I- Les changements d’état des
corps purs.
a)- Définition :
- Une transformation physique a lieu
quand une espèce passe d’un état physique (solide, liquide ou gaz) à un autre
état physique.
b)- Les noms des changements
d’état : diagramme :
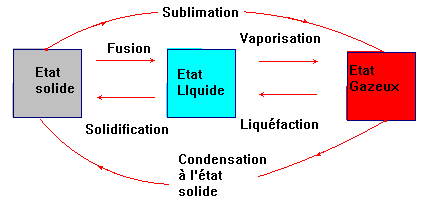
-
Remarque : il ne faut pas confondre
fusion et dissolution.
-
Lorsque du sucre est introduit dans
l’eau, il est inexact de dire que le « sucre fond ».
-
Le sucrer de fond pas, il ne passe pas
de l’état solide à l’état liquide.
-
Le sucre se dissout dans l’eau. L’eau
est le solvant et le sucre le soluté.
-
On obtient une solution aqueuse sucrée.
c)- Description des
différents états de la matière :
-
L’état gazeux :
c’est un état dispersé.
-
Les molécules ou les atomes sont éloignés
les uns des autres et se déplacent dans toutes les directions de façon
désordonnée.
-
Les interactions entre les entités
chimiques sont faibles.
-
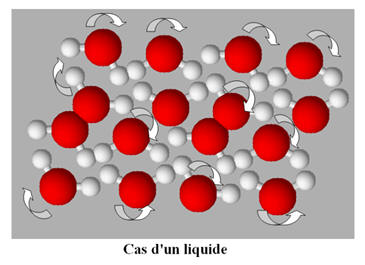
L’état liquide et l’état solide.
-
L’état liquide comme l’état solide est
un état condensé.
-
À l’état liquide,
les entités chimiques sont les unes contre les autres et peuvent glisser les
unes sur les autres.
-
Les entités chimiques sont en mouvement
constant.
-
À l’état solide,
les entités chimiques sont en contact les unes avec les autres.
-
On est en présence d’un assemblage
compact et ordonné.
-
Les entités chimiques sont en vibration
constante autour d’une position d’équilibre.
d)- Changement d’état
physique :
-
Lors d’une transformation physique,
l’espèce chimique ayant subi la transformation ne change pas.
-
Seules les interactions entre les
molécules sont modifiées.
-
Une élévation de température conduit à
une agitation plus grande des molécules.
-
Les changements d’état d’un corps pur
s’effectuent à température constante sous une pression donnée.
-
Les deux états coexistent lors d’un
changement d’état :
![]() Cas de l’eau :
Cas de l’eau :
![]() On chauffe un morceau de glace pris à
- 20 °C,
On chauffe un morceau de glace pris à
- 20 °C,
-
Dans un premier temps, la quantité de
chaleur cédée au système (le bloc de glace) permet d’augmenter la température de
la glace.
-
Lorsque la température du bloc de glace
est égale à 0 °C (température de fusion de
l’eau), la glace fond à température constante.
-
La quantité de chaleur cédée au système
transforme la glace (eau à l'état solide) en eau à l'état liquide.
-
Lorsque toute la glace a disparu, la
quantité de chaleur cédée au système permet d'augmenter la température de l'eau
à l'état liquide.
- Lorsque la température de l'eau à l'état liquide est égale à 100 °C (température de vaporisation de l’eau sous la pression atmosphérique),
- Elle se transforme en vapeur d'eau à température constante.
-
La quantité de chaleur cédée au système
transforme l’eau à l'état liquide en de l’eau à l'état gazeux.
-
Diagramme :
-
un
transfert d'énergie sous forme de chaleur modifie l'énergie microscopique du
système.
2)- Équation d’un changement d’état :
-
L’équation d’un changement d’état est
l’écriture symbolique, à l’échelle macroscopique, de la transformation physique
d’une espèce.
-
Exemple : cas de l’eau qui passe de
l’état solide à l’état liquide.
-
La fusion de l’eau peut être modélisée
par l’équation suivante :
H2O
(s)
→ H2O
(ℓ)
1)- Énergie massique de changement
d’état :
-
Lors d’une
fusion,
d’une vaporisation
ou d’une sublimation,
-
L’espèce chimique change d’état
physique et son énergie augmente
-
Alors que celle du milieu extérieur
diminue :
-
La transformation est
endothermique (Q > 0)
-
Le milieu extérieur se refroidit.
-
Lors d’une
solidification,
d’une liquéfaction
ou d’une
condensation,
-
L’espèce chimique change d’état
physique et son énergie diminue
-
Alors que celle du milieu extérieur
augmente :
-
La transformation est
exothermique (Q < 0)
-
Le milieu extérieur se réchauffe.
2)- Chaleur latente de changement
d’état :
-
L’énergie transférée
lors d’un changement d’état d’un kilogramme d’une espèce chimique est l’énergie
massique de changement d’état, notée L
de cette espèce.
-
Cette énergie est aussi appelée chaleur
latente de changement d’état.
-
Elle s’exprime en J. kg–1.
-
L’énergie
Q transférée lors du changement d’état
d’une masse m de l’espèce
est donnée par la relation suivante :
|
Q
= m . L |
Q :
énergie en joule J |
|
m :
masse en kilogramme : kg |
|
|
L :
chaleur latente en J. kg–1 |
3)- Énergie
transférée lors d’une élévation de température d’une espèce chimique sans
changement d’état.
- L’énergie Q transférée lorsqu'une masse m de substance dont la température varie
d’une valeur initiale
θi à une valeur finale
θf
est donnée par la relation suivante :
|
Q
= m . c . Δθ
Ou
Q
= m . c . (θf – θi) |
Q :
Énergie en joule J |
|
m :
Masse en kilogramme : kg |
|
|
c :
Capacité thermique massique : J. kg–1 . ° C–1 |
|
|
Δθ =
(θf
– θi) Variation de température : ° C |
-
Exemple :
- Calculer la quantité de chaleur nécessaire pour
obtenir
- On donne :
- Masse volumique de l’eau :
ρ = 1,0 kg . L–1
- Capacité thermique massique de l’eau à l’état
liquide :
- c =
4,18 kJ . kg – 1
. ° C– 1 .
- On
détermine la valeur de l’énergie transférée à
l’eau lors de cette élévation de température
- Q = m . c . Δθ = m
.
c . (θf –
θi) = 80 × 4,18 × (80 –
20)
- Q = 2,0 ×
10
4 kJ.
- Remarque :
- Si θf
> θi =>
Q > 0, la substance
reçoit de l'énergie du milieu extérieur.
- Si θf
< θi
=> Q <
0, la substance cède de l'énergie au milieu extérieur.
4)- Détermination expérimentale : Mesure de la capacité thermique du laiton.
-
Le calorimètre constitue un système
thermiquement isolé.
-
Il n’y a pas de transfert d’énergie
vers le système extérieur pendant la durée de l’expérience :
-
En conséquence, la somme des énergies
transférées, à l’intérieur du calorimètre, par les différentes parties du
système est nulle :
-
Q1
+ Q2
+ Q3
+ … = 0
|
Transformations physiques |
|
1)- Exercice 3 page 104 2)- Exercice 6 page 104 : 3)- Exercice 7 page 104 : 4)- Exercice 8 page 104 : 5)- Exercice 10 page 105 : 6)- Exercice 11 page 105 :
7)- Exercice 12 page 105 : 8)- Exercice 14 page 105 : 9)- Exercice 23 page 108 : |
|
|