|
Phys. N° 07 |
Transferts d'énergie et énergie interne. Cours. |
|
Programme 2011 :
Physique et
Chimie
Programme 2020 :
Physique et
chimie
Pour aller plus loin :
|
Mots clés : Autres formes d'énergie ; Transferts d'énergie ; Transfert thermique ; Energie interne ; Variation de l'énergie interne d'un système ; Thermodynamique ; ... |
|
|
1)- Les autres effets du travail d’une force.
- On a vu que le travail d’une force peut modifier la valeur de la vitesse d’un objet et modifier son altitude.
a)- Élévation de la température d’un objet.
- Une force peut provoquer l’élévation de la température d’un objet.
- C’est le cas des forces de frottement.
- Une élévation de la température d'un système augmente l'agitation des particules qui constituent le système,
- Elle augmente l'agitation thermique (il y a augmentation de l'énergie cinétique microscopique).
b)- Changement d’état d’un corps pur.
- Une force peut provoquer l’élévation de la température d’un corps,
- Mais elle peut aussi provoquer le changement d’état physique d’un corps à température constante.
- Lorsqu'un corps change d'état physique, son stock d'énergie varie, ceci est lié aux modifications survenues au niveau de la structure microscopique interne.
c)- Déformation d’un objet élastique.
- Une force peut provoquer l’allongement, la déformation d’un ressort.
- Lorsque le ressort est tendu, les positions relatives entre les constituants du matériau sont modifiées.
- Lorsqu’il est allongé, le ressort accumule de l’énergie potentielle élastique.
- À l'échelle microscopique, les particules constituant le système sont animées de mouvements individuels.
- Cette agitation augmente avec la température, on l'appelle l'agitation thermique.
- Au niveau microscopique, à toute liaison entre deux particules du système est associée une énergie potentielle microscopique.
- L’énergie interne est la somme des énergies cinétique et potentielle microscopiques, c’est l'énergie liée à sa structure interne microscopique, notée Umic.
II-
Cas du transfert thermique.![]()
1)- Transfert thermique spontané.
- Exemple : cas d’une tasse de café qu’on laisse à la température ambiante.

- Au cours du temps, la température du café diminue.
- La tasse de café constitue le système d’étude S, l’autre système S’ est constitué par le milieu extérieur.
- Un transfert d’énergie s’effectue de la tasse de café vers le milieu extérieur.
- La tasse de café cède de l’énergie sous forme de chaleur, notée Q, au milieu extérieur.

2)- Effets d’un transfert thermique.
- On appelle chaleur, l'énergie transférée sous forme d'énergie cinétique microscopique désordonnée.
- On note Q l'énergie transférée sous forme de chaleur.
- Un apport de chaleur se manifeste par :
- Une augmentation de la température du corps.
- Ou un changement d'état du corps.
- Exemple :
-
Si l'on chauffe un morceau de glace pris à
- 20
- Dans un premier temps, la quantité de chaleur cédée au système (le bloc de glace) permet augmenter la température de la glace.
- Lorsque la température du bloc de glace est égale à
- La quantité de chaleur cédée au système transforme la glace (eau à l'état solide) en eau à l'état liquide.
- Lorsque toute la glace a disparu, la quantité de chaleur cédée au système permet d'augmenter la température de l'eau à l'état liquide.
- Lorsque la température de l'eau à l'état liquide est égale
à
- La quantité de chaleur cédée au système transforme l’eau à l'état liquide en de l’eau à l'état gazeux.
- Graphe :
- un transfert d'énergie sous forme de chaleur modifie l'énergie microscopique du système.
- On peut augmenter l'énergie microscopique d'un système par transfert de chaleur Q, par transfert d'énergie rayonnante WR, par transfert de travail électrique WE et mécanique WM.
3)- Modes de transferts thermiques.
- Le transfert d'énergie par chaleur peut se faire par convection et par conduction.
- Transfert par conduction :
- Si l'on chauffe l'extrémité d'une
barre métallique, on remarque que la température de l'autre
extrémité augmente très vite.
- Les particules de la partie
chaude communiquent une partie de l'agitation thermique aux
particules voisines et ainsi de suite.
- L'agitation thermique se transmet
de proche en proche de la région chaude vers la région froide
sans transport de matière.
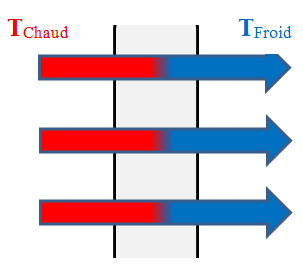
- Les particules de la partie chaude communiquent une partie de l'agitation thermique aux particules voisines et ainsi de suite.
- L'agitation thermique se transmet de proche en proche de la région chaude vers la région froide sans transport de matière.
- Transfert par convection :
- Dans les fluides, le transfert de chaleur de fait grâce aux courants de convection.
- L'air chaud est plus léger que l'air froid.
- L'air chaud s'élève et en s'élevant, se refroidit en échangeant de l'énergie avec les couches supérieures.
- Le transfert par convection se fait avec transfert de matière.
- Il existe de bons conducteurs thermiques comme les métaux et de bons isolants thermiques comme la laine de verre, le polystyrène, le vide…
- Une paroi parfaitement perméable à la chaleur est dite diathermane et une paroi imperméable à la chaleur est dite adiabatique.
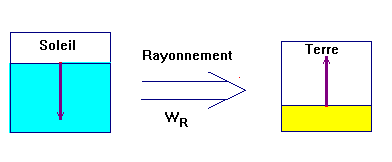
4)- Transfert d'énergie par rayonnement.
- L'énergie transportée sous forme de radiations électromagnétiques est appelée énergie rayonnante.
- Elle est notée WR.
- Elle s'exprime en Joule.
- Tout corps chaud émet des radiations électromagnétiques qui transportent de l'énergie.
- Un système peut stocker :
- de l'énergie cinétique macroscopique EC
- de l'énergie potentielle macroscopique EP
- de l'énergie liée à sa structure interne microscopique Umic
- On appelle énergie mécanique la somme de l'énergie cinétique macroscopique et la somme de l'énergie potentielle macroscopique :
- EM = EC + EP
- L'énergie totale E du système est la somme de l'énergie mécanique et de l'énergie interne microscopique :
- E
=
EM
+
Umic =
EC
+
EP +
Umic
2)- Variation d’énergie d’un système.
- Le bilan énergétique dépend du système choisi.
- Avant tout bilan, il faut préciser le système d’étude.
- L’énergie d’un système varie s’il reçoit ou cède de l’énergie.
- On peut écrire que :
- ΔES = E2 - E1 = Q + W
- Tout transfert d’énergie reçu par le système est compté positivement.
- Tout transfert d’énergie cédé par le système est compté négativement.
- Un système est isolé si aucun transfert d'énergie n'est possible entre le système et le milieu extérieur.
- Considérons un système isolé S :
- Au temps t1, il possède l'énergie E1
- Au temps t2, il possède l'énergie E2
- La variation d'énergie du système entre les instants t1 et t2 se note : ΔE = E2 - E1 = 0.
- L'énergie totale d'un système isolé se conserve, elle est constante.
- Remarque : il peut se produire des transferts d'énergie à l'intérieur du système isolé, mais l'énergie totale du système reste la même.
IV-
Variations de l’énergie interne d’un système.![]()
1)- Transfert par chaleur produisant une élévation de température.
- La variation d’énergie interne d’une masse m de substance dont la température varie d’une valeur initiale θi à une valeur finale θf est donnée par la relation suivante :
- ΔU
= m . c . (
θf
-
θi )
|
ΔU en joule J |
|
m en kilogramme kg |
|
c capacité thermique massique
J.kg – 1.° C–
1 |
|
θf
−
θi
températures
en °C |
- Remarque :
- La capacité thermique massique
c d’une
substance correspond au transfert thermique nécessaire pour faire varier de 1
° C une masse de
- Exemple : Calculer la quantité de chaleur nécessaire pour obtenir
- On
donne : masse volumique de l’eau : ρ =
- Quantité de chaleur nécessaire :
- ΔU = Q = m . c . ( θf
-
θi
) =>
Q = 80 x
4,18 x (80 – 20)
=>
Q = 2,0
x 10 4
kJ.
- Remarque :
- Si θf > θi => Q > 0, la substance reçoit de l'énergie du milieu extérieur.
- Si θf < θi => Q < 0, la substance cède de l'énergie au milieu extérieur.
2)- Transfert d'énergie produisant un changement d'état.
|
Transfert d'énergie produisant un changement d'état : La variation d'énergie par changement d'état d'une masse m de corps pur sous une pression P et à la température T (température de changement d'état est égale - au produit de la masse m du corps pur considéré - par la chaleur latente de changement d'état L. :
- ΔU
= m . L |
|
- L dépend de la nature de la substance, de la pression P ou de la température T. - On distingue différentes chaleurs latentes : - chaleur latente de fusion : Lf (passage de l'état solide à l'état liquide). - Chaleur latente de solidification : LS (passage de l'état liquide à l'état solide). |
|
- Unités : - Q en Joule J, - m en kilogramme kg - L en J.kg– 1 |
- Lorsque le système passe de l'état solide à l'état liquide,
- Son énergie microscopique augmente (l'état liquide est un état moins ordonné que l'état solide),
- L'agitation thermique augmente, le système reçoit de l'énergie, il faut un apport de chaleur :
- ΔU = m . Lf >
0
=>
L f >
0
- pour la transformation inverse, le système cède de l'énergie :
- ΔU = m . LS <
0
=>
LS <
0
- En conséquence : Lf = - LS
- Exemple pour l'eau : Lf = - LS = 335 kJ.kg– 1 et Lv = - LL = 2260 kJ.kg– 1.
- Les différents changements d’état :

a)- Exercice 16 page 146.
b)- Exercice 19 page 146.