|
TP Physique N° 09 |
Transferts Thermiques. Mesure de la capacité thermique massique du laiton. Correction |
|
|
Mots clés : Séances de travaux pratiques de physique, Transferts thermiques, capacité thermique massique du laiton, laiton, masse vomumique du laiton, cuivre, zinc, masse volumique, calorimètre, thermomètre, système isolé, vase Dewar, équilibre thermique, transferts d'énergie, équation calorimétrique, expression littérale des transferts d'énergie, principe de conservation de l'énergie, ; ... |
|
|
► Matériel pour chaque groupe : calorimètre et accessoires ; un thermomètre ; éprouvette graduée de 250 mL ;
► Un chronomètre ; une masse marquée en laiton de 200 g.
► Matériel : un dispositif de chauffage ; un récipient et un support ; un thermomètre.
![]() Mesurer la capacité thermique massique du laiton.
Mesurer la capacité thermique massique du laiton.
|
|
Masse
volumique |
Capacité thermique massique |
|
Cuivre |
8,96 g. cm–3 |
380 J.kg–1.K–1 |
|
Zinc |
7,13 g. cm–3 |
390 J.kg–1.K–1 |
|
Laiton |
? |
377 J.kg–1.K–1 |
|
Eau |
1,00 g. cm–3 |
c1 = 4,18 kJ.kg–1.K–1 |
|
Capacité thermique du calorimètre + accessoires |
C = 150 J.K–1 |
|
1)- Première étape :
a)- On chauffe l'eau d'un récipient dans lequel les masses marquées sont immergées.
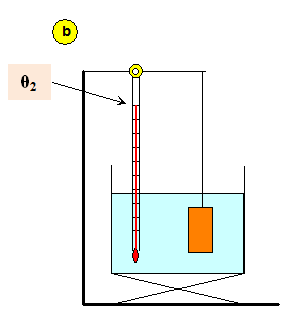
Les masses marquées ne doivent pas être en contact avec les parois du récipient (schéma (b)).
b)- On arrête le chauffage du récipient avant l'ébullition de l'eau.
2)- Deuxième étape :
a)- Introduire dans un calorimètre une masse d'eau m1 = 250 g, prise au robinet (schéma (a)).
b)- Attendre l'équilibre thermique en agitant et mesurer alors la température d'équilibre θ1 =
3)- Troisième étape :
a)- Chaque groupe vient avec son calorimètre et ces accessoires à tour de rôle.
b)- relever la température θ2 de l'eau qui est aussi celle du métal, prendre une masse marquée et la plonger rapidement dans l'eau du calorimètre (schéma (c)).
c)- Agiter et relever la température θ toutes les minutes, ceci pendant 15 min.
- Tableau de valeurs :
|
t
min |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
θ
°C |
...... |
..... |
..... |
..... |
..... |
..... |
..... |
..... |
..... |
..... |
..... |
..... |
..... |
..... |
..... |
..... |
IV- Résultats et exploitations.
1)- Faire les schémas des différentes étapes.
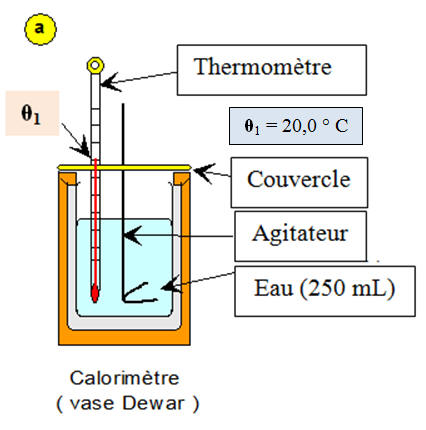
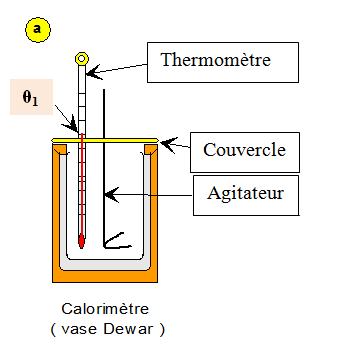
a)- Première étape :
- On introduit la masse d'eau m1 = 250 g dans le calorimètre.
- On met en place, le thermomètre, l’agitateur et le couvercle.
- On attend l’équilibre thermique tout en agitant.
- Valeur de la température : θ1 = 20,0 ° C.
- Schéma
b)- Deuxième étape :
- On prend une masse marquée.
- On note la température de la masse marquée : θ2 = 80,0 ° C.
- Schéma :

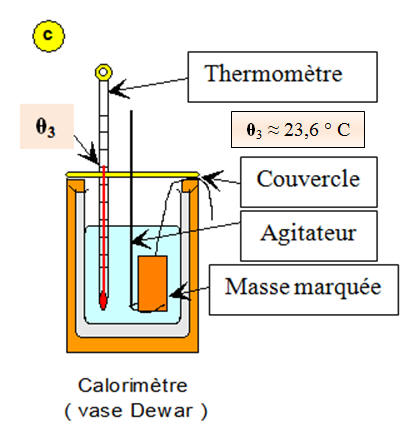
c)- Troisième étape :
- On plonge rapidement la masse marquée dans le calorimètre.
- On met en place le couvercle, le thermomètre et l’agitateur.
- Tout en agitant, on relève la valeur de la température toutes les minutes.
- Schéma :
2)- Mesures.
a)- Tracer θ = f (t) et en déduire la température d'équilibre θ3.
- Tableau de mesures :
|
t
min |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
θ
°C |
20,0 |
21,0 |
21,5 |
21,9 |
22,3 |
22,6 |
22,9 |
23,1 |
23,3 |
23,5 |
23,5 |
23,6 |
23,6 |
23,5 |
23,5 |
23,5 |
- Graphe : θ = f (t)
- θ3 = 23,5 ° C.
b)- Donner les résultats des différentes mesures sous forme de tableau.
|
|
État initial |
État final |
|
Le calorimètre et ses accessoires |
θ1 = 20,0 ° C |
θ3 = 23,5 ° C |
|
La masse m1 d’eau |
θ1 = 20,0 ° C |
θ3 = 23,5 ° C |
|
La masse m2 de laiton |
θ2 = 80,0 ° C |
θ3 = 23,5 ° C |
3)- Évaluation des transferts d'énergie.
- Préciser le système étudié en nommant les différentes parties.
- S1 : Le calorimètre et ses accessoires :
- S2 : La masse m1 = 250 g d’eau.
- S3 : La masse m2 = 200 g de laiton.
- Le système étudié : S = { S1 + S2+ S3}
- Représenter les transferts d'énergie de chaque partie du système sous forme de tableau en indiquant les caractéristiques (température, état physique).
|
S1 |
|
Transfert thermique |
|
|
Le calorimètre et ses accessoires |
θ1 = 20,0 ° C |
Qcal
→ |
θ3 = 23,5 ° C |
|
|
État solide |
|
|
S2 |
|
Transfert thermique |
|
|
La masse m1 = 250 g d’eau |
θ1 = 20,0 ° C |
Q1
→ |
θ3 = 23,5 ° C |
|
|
État Liquide |
|
|
S3 |
|
Transfert thermique |
|
|
La masse m2 = 200 g de laiton |
θ2 =80,0 ° C |
Q2
→ |
θ3 = 23,5 ° C |
|
|
État Solide |
|
- Donner l'expression littérale des transferts d'énergie de chaque partie du système.
- On note :
- Qcal l'énergie transférée par le calorimètre et ces accessoires,
- Q1 l'énergie transférée par l'eau,
- Q2 l'énergie transférée par la masse marquée.
|
|
|
État initial |
État final |
|
Le calorimètre et ses accessoires |
Qcal = C (θ3 – θ1) |
θ1 |
θ3 |
|
La masse m1 d’eau |
Q1= m1 . c1 (θ3 – θ1) |
θ1 |
θ3 |
|
La masse m2 de laiton |
Q2 = m2 . c2 (θ3 – θ2) |
θ 2 |
θ3 |
- En appliquant le principe de conservation de l'énergie, déterminer l'équation calorimétrique.
- Équation calorimétrique :
- Qcal + Q1 + Q2 = 0
- C (θ3 – θ1) + m1 . c1 (θ3 – θ1) + m2 . c2 (θ3 – θ2) = 0
- En déduire l'expression littérale de la capacité thermique massique c2 du laiton.
- Expression littérale de la capacité thermique massique c2 du laiton
-

- Calculer sa valeur. Donner l'unité.
- Valeur de la capacité du laiton :
-
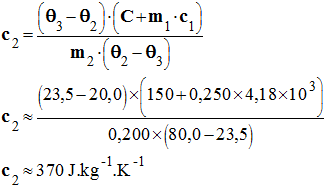
- Comparer la valeur expérimentale à celle donnée dans le tableau. Conclusion.
- Comparaison :
- Incertitude relative sur la valeur de c2 :
-

- La valeur expérimentale est en accord avec la valeur donnée dans le tableau :
- Remarque :
- Si pour la valeur de la température d’équilibre, on prend : θ3 = 23,6 ° C
- On trouve pour la valeur de la capacité du laiton :
- c2 = 381 J.kg–1.K–1
- Exprimer la température d’équilibre θ3, en fonction de θ1, θ2, m1, m2, c1, c2 et C.
- Qcal + Q1 + Q2 = 0
- C (θ3 – θ1) + m1 . c1 (θ3 – θ1) + m2 . c2 (θ3 – θ2) = 0
-

- Déterminer la valeur de θ3 à partir de la connaissance des valeurs données dans le tableau et des mesures de θ1 et θ2.
-

V- Étude complémentaire. (à finir)
1)- Déterminer par la méthode de votre choix le volume de la masse marquée.
- Détermination du volume de la masse marquée :
- On mesure la hauteur à l’aide d’une règle et le diamètre à l’aide d’un pied à coulisse.
- H ≈
- D ≈
- Volume de la masse marquée :
-
2)- Déterminer la valeur de la masse volumique du laiton.
- Masse volumique du laiton :
-
3)- En déduire la composition massique en cuivre et en zinc du laiton.
- Composition massique en cuivre et en zinc du laiton :
-
► Additif :
-
Table de masse volumique du laiton simple en fonction de
la teneur en cuivre et zinc.
Les proportions sont en masse.
- La masse volumique du cuivre vaut 8,920 g . cm–3.
- La masse volumique du zinc vaut 7,140 g . cm–3.
|
Masse volumique du laiton en g/cm3 (si on prend du laiton composé uniquement de ces deux matériaux) |
|||||
|
Formule |
% cuivre |
% zinc |
ρ
(laiton)
|
ρ
(laiton classique) |
ρ
(empirique) |
|
Cu |
100 |
0 |
8,92 |
8,92 |
8,92 |
|
CuZn5 |
95 |
5 |
8,86 |
8,81 |
8,86 |
|
CuZn10 |
90 |
10 |
8,80 |
8,70 |
8,81 |
|
CuZn15 |
85 |
15 |
8,75 |
8,60 |
8,76 |
|
CuZn20 |
80 |
20 |
8,67 |
8,50 |
8,70 |
|
CuZn28 |
72 |
28 |
8,55 |
8,34 |
8,62 |
|
CuZn30 |
70 |
30 |
8,53 |
8,30 |
8,60 |
|
CuZn33 |
67 |
33 |
8,50 |
8,24 |
8,57 |
|
CuZn36 |
64 |
36 |
8,45 |
8,19 |
8,54 |
|
CuZn40 |
60 |
40 |
8,39 |
8,11 |
8,50 |
- Détermination de la masse volumique du laiton :
-
La formule classique : 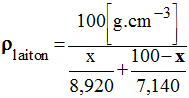
- La grandeur x = % massique cuivre.
- Cette relation n'est pas correcte, car l'arrangement des atomes de cuivre et de zinc change lors du mélange de ces deux métaux.
- Une formule empirique donnant de bons résultats pour des proportions de cuivre allant jusqu'à 40 % est :
-
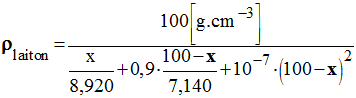
- La grandeur x = % massique cuivre
- Graphe :
- Incertitude relative pour 60 % de cuivre :
-
Formule classique :

-
Formule empirique :

- Incertitude relative sur les différentes mesures :
- Hauteur H : mesure au mm
- Diamètre D : mesure au 1/10e de mm
- Conclusion :
|
|