|
Descrition d'un fluide au repos |
|
|
|
|
|
|
2)- Aspect macroscopique et microscopique d’un fluide au repos : |
|
III-
La
pression dans un fluide incompressible au repos.
1)-
Différences entre les liquides et les gaz : |
|
Pour s'auto-évaluer
Les fluides au
repos. La force pressante.
La pression dans
un fluide incompressible au repos.
La pression dans
un gaz au repos. |
|
1)-
Exercice 04 page 204 : Connaître la masse
volumique : 2)-
Exercice 06 page 204 :Décrire une
propriété des molécules. 3)-
Exercice 08 page 204 : Schématiser une
force pressante. 4)-
Exercice 10 page 204 : Force pressante,
pression et surface. 5)-
Exercice 11 page 205 : Calculer la valeur
d’une force pressante. 6)-
Exercice 13 page 205 : Étudier une force
pressante. 7)-
Exercice 16 page 205 : Déterminer une
différence de coordonnées verticales. 8)-
Exercice 19 page 205 : Lier pression d’un
gaz et volume. 9)-
Exercice 23 page 206 : Pression en plein
vol. 10)-
Exercice 24 page 206 : 11)-
DS N° 01 (30 min) : La manœuvre de
Valsalva : Exercice 37 page 2011 : 12)-
DS N° 02 (30 min): Le parachute de
palier : Exercice 38 page 211.
|
a)-
Les états de la matière :
-
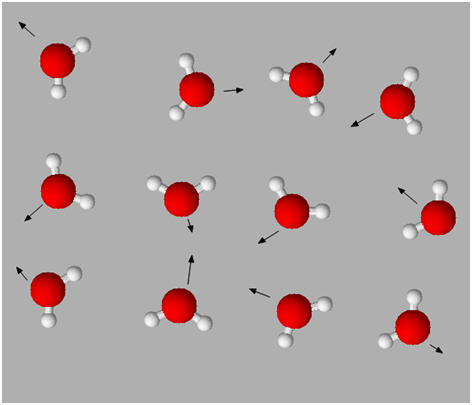
L’état gazeux :
c’est un état
dispersé.
-
Les molécules et les ions sont
éloignés les uns des autres et se déplacent dans toutes les directions de façon
désordonnée.
-
Les interactions entre les entités
chimiques sont faibles.
-
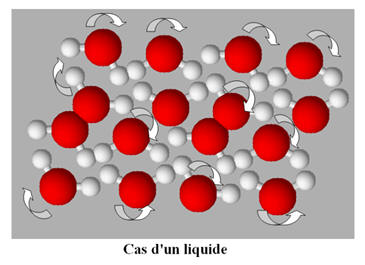
L’état liquide et l’état solide.
-
L’état liquide comme l’état solide
est un état
condensé.
-
À l’état liquide,
les entités chimiques sont les unes contre les autres et peuvent glisser les
unes sur les autres.
-
Les entités chimiques sont en
mouvement constant.
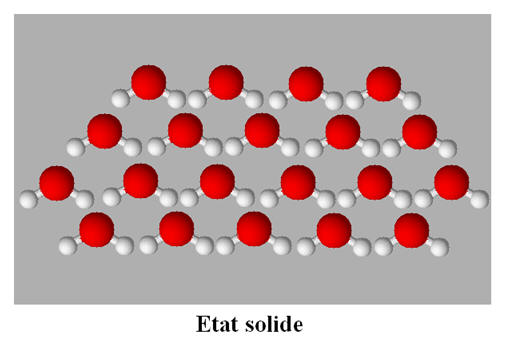
-
À l’état solide,
les entités chimiques sont en contact les unes avec les autres.
-
On est en présence d’un assemblage
compact et ordonné.
-
Les entités chimiques sont en
vibration constante autour d’une position d’équilibre.
b)-
Les fluides :
-
On regroupe sous l’appellation de
fluide : les liquides et les gaz.
-
Un fluide est constitué de
particules en mouvement
qui se déplacent dans toutes les directions.
-
Un fluide constitue un milieu
matériel déformable.
-
L’étude suivante porte sur les
fluides au repos.
2)-
Aspect macroscopique et microscopique d’un fluide au repos :
-
À l’échelle macroscopique, un
fluide au repos n’a pas de mouvement d’ensemble.
-
À l’échelle microscopique
pourtant, les molécules qui constituent le fluide sont en mouvement incessant et
désordonné.
-
Les grandeurs macroscopiques de
description du fluide reflètent le comportement microscopique des entités qui le
constituent.
|
FLUIDE AU REPOS |
||
|
À l’échelle
macroscopique |
↔ |
À l’échelle
microscopique |
|
Le fluide n’a pas
de
mouvement
d’ensemble |
↔ |
Les entités du
fluide sont en
mouvement
incessant
et désordonné |
|
La température
T (° C),
mesurée par un
thermomètre |
↔ |
Telle traduit
l’agitation des entités.
Plus l’agitation
est importante et
plus la
température est élevée. |
|
La pression P
(Pa), mesurée
avec un manomètre |
↔ |
Elle est liée aux
chocs des entités.
Plus il y a de
chocs et plus
la pression est
élevée. |
|
La masse
volumique
pour un liquide
que pour un gaz |
↔ |
Elle traduit la
proximité des entités.
Elles sont plus
proches dans
un liquide que
dans un gaz. |
1)-
Caractéristiques de la force pressante :
-
La force pressante résulte des
chocs entre les entités, qui constituent le fluide, et les parois du récipient.
-
Un fluide exerce une force
pressante sur les parois du récipient qui le contient :
|
|
|
|
|
Point
d’application :
on choisit le
centre de
la surface
pressée |
|
Direction :
perpendiculaire
à la paroi |
|
|
Sens : orienté du
fluide
vers la paroi |
|
|
Valeur : F
en newton N |
|
|
Force pressante
exercée
par le fluide sur
la
membrane
élastique |
|
-
Remarque :
-
La valeur de la force pressante ne
dépend pas de l’orientation de la paroi (les particules se déplacent dans toutes
les directions de façon désordonnée).
-
Lorsqu’un fluide au repos est au
contact d’une paroi, il exerce sur celle-ci une force pressante
![]() .
.
-
Schéma :
|
|
|
|
|
Point
d’application :
on choisit le centre de la
surface pressée |
|
Direction :
perpendiculaire à la paroi |
|
|
Sens :
orienté du fluide vers la paroi |
|
|
Valeur : F
en newton (N) |
|
2)- Valeur de la force pressante.
-
La valeur
F
de la pression dépend de la pression
P
du fluide et de la surface de contact
S
-
Relation :
|
F
= P . S |
P :
Pression en N . m–2 ou pascal (Pa) |
|
S :
Surface de contact en m2 |
|
|
F ;
force pressant en newton (N) |
III- La
pression dans un fluide incompressible au repos.
1)-
Différences entre les liquides et les gaz :
-
À l’échelle macroscopique la masse
volumique d’un liquide est supérieure à la masse volumique d’un gaz :
ρliq
> ρgaz
-
Ceci vient du fait que l’état
liquide est un état condensé, alors que l’état gazeux est un état dispersé.
-
Les entités dans un gaz sont plus
espacées.
-
Les gaz sont des fluides
compressibles.
-
La masse volumique d’un gaz
ρgaz
varie lorsque la pression du gaz varie.
-
Les liquides sont des fluides
incompressibles.
-
La masse volumique d’un liquide
ρliq
ne varie pratiquement pas lorsque la pression varie.
2)-
Pression dans l’eau et profondeur.
-
La pression de l’eau augmente avec
la profondeur.
-
La pression de l’eau s’ajoute à
celle de l’air.
-
On ajoute 1 × 105
Pa tous les 10 m.
-
Par définition, l’unité légale de
pression est le pascal de symbole Pa.
-
C’est la pression exercée par une
force pressante de 1 N sur une surface plane de 1 m2.
-
On emploie couramment d’autres
unités :
-
Le bar
(bar) : 1 bar = 105
Pa
-
L’hectopascal : 1 hPa = 102
Pa = 1 mbar
3)-
Loi fondamentale de la statique des fluides .
-
Elle permet :
-
De relier la différence de
pression entre deux positions dans un fluide incompressible et la différence des
coordonnées verticales de ces positions ;
-
D’en déduire la pression
P en une position de coordonnée
verticale z donnée
-
Ou la coordonnée verticale
z pour une pression
P
donnée.
-
Relation :
|
PB
– PA
= ρ . g . ( zA
– zB)
|
P :
Pression en pascal (Pa) |
|
ρ
: masse volumique du fluide au repos (kg .
m–3) |
|
|
g :
intensité de la pesanteur (N . kg–1) |
|
|
z :
coordonnée verticale (m) L’axe des
coordonnées verticales est orienté
vers le haut |
-
Schéma :
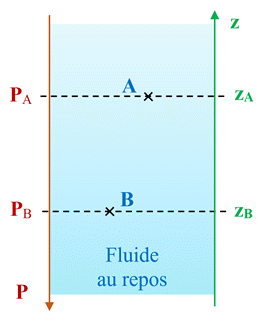
-
Deux points
A
et B,
situés dans un même liquide au repos, de mêmes coordonnés verticales (zA = zB)
sont à la même pression (PA = PB).
-
Deux points
A
et B,
situés dans un même liquide au repos, de coordonnés verticales différentes (zA ≠ zB)
sont à des pressions différentes (PA ≠ PB).
IV- La
pression dans un gaz au repos.
a)-
Protocole expérimental :
-
Une quantité d’air est enfermé
dans la seringue graduée en mL.
-
L’embouchure de la seringue est
fermée par un capteur de pression.
-
Le capteur de pression est gradué
en hPa.

b)-
Les mesures :
-
On déplace lentement le piston de
la seringue.
-
Pour différentes positions du
piston, on relève les valeurs du volume
V
et de la pression
P
du gaz.
-
On fait une dizaine de mesures.
-
Entre chaque mesure, on laisse le
dispositif expérimental se stabiliser.
-
Le volume initial d'air dans la
seringue est : Vi
= 30 mL à la pression atmosphérique :
-
Patm = 963 hPa.
-
Tableau de valeurs :
|
P
(hPa) |
1785 |
1393 |
1139 |
963 |
826 |
727 |
644 |
576 |
521 |
475 |
|
V
(mL) |
15,0 |
20,0 |
25,0 |
30,0 |
35,0 |
40,0 |
45,0 |
50,0 |
55,0 |
60,0 |
|
1 / P × 10–4
(hPa –1) |
5,60 |
7,18 |
8,78 |
1,04 |
1,21 |
1,38 |
1,55 |
1,74 |
1,92 |
2,11 |
-
Le volume initial d'air dans la
seringue est : Vi
= 30 mL à la pression atmosphérique :
-
Patm = 963 hPa.
c)-
Exploitation des mesures :
-
Tracer
V
= f
(P) et
V
= f
(1/P)
-
À partir du graphique, donner
l’expression de V
en fonction de P.
-
Déduire de ce résultat que le
produit P. V
= constante pour une quantité
donnée de gaz, à température constante.
-
Graphe
V
= f
(P) :
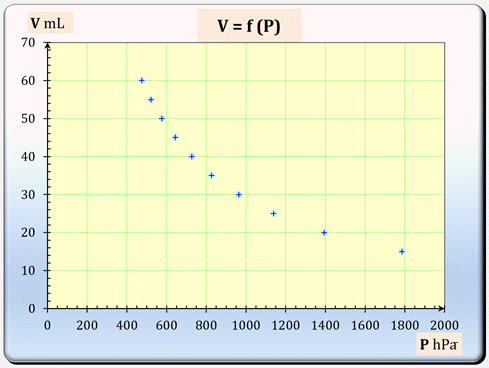
-
Il n’existe pas de relation simple
entre V
et P.
-
On peut faire tracer une courbe de
tendance par le tableur Excel et chercher le modèle le mieux adapté.
-
Sélectionner le graphique, puis
cliquer sur le
![]()

-
Sélectionner « Autres options ».
-
Format de la courbe de tendance :
-
Cocher le modèle « Puissance »,
puis cocher : « Afficher l’équation sur le graphique »,
-
Puis cocher : « Afficher le
coefficient de détermination ».
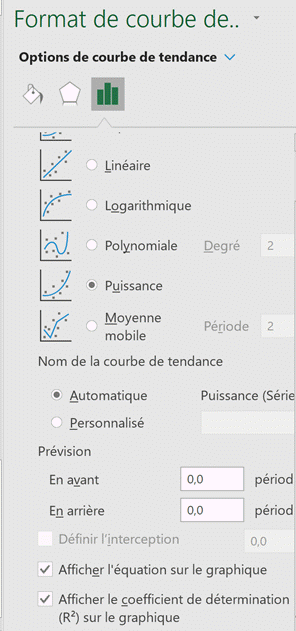
-
On obtient l’affichage suivant :
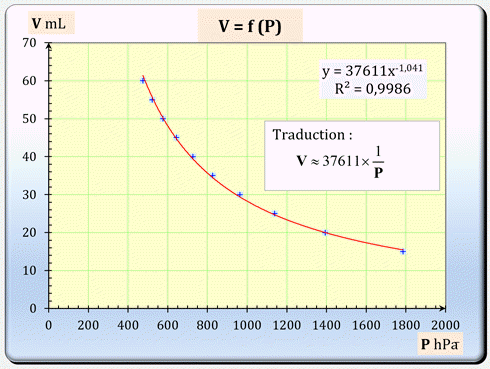
-
![]()
-
Graphe : V =
f
(1/P)
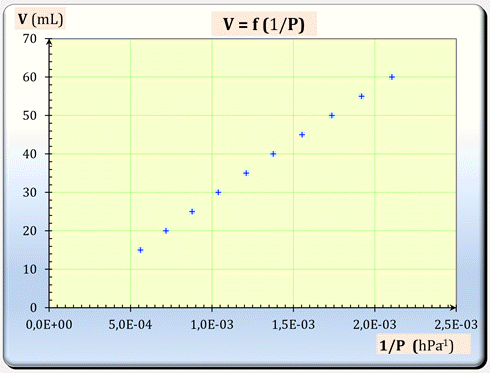
-
Les points sont sensiblement
alignés, il existe une relation simple entre
V
et (1 / P).
-
Exploitation :
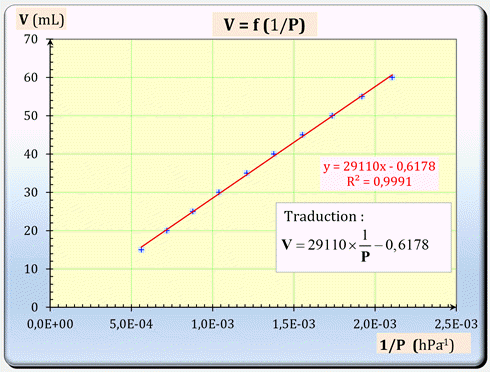
-
La droite obtenue ne passe pas par
l’origine :
-
Équation : ![]()
-
Elle est du type : ![]()
-
Le terme « a » est le coefficient
directeur de la droite tracée.
-
Le terme « b » est l’ordonnée à l’origine.
-
![]()
-
Le terme « b » a la dimension d’un volume.
-
Schéma :
-
Il représente le volume
V0
d’air présent dans le tube qui relie la seringue au capteur et le capteur.
-
– b
= V0
≈ 0,62 mL.
-
On peut écrire que :
-
![]()
-
Ou : ![]()
-
Le coefficient de détermination R2
≈ 0,9991≈ 1
-
Il y a bien une dépendance
linéaire entre V’
et (1 / P).
-
En conclusion, l’expérience
vérifie une loi de la forme :
-
V .
P
= a =
constante.
-
C’est la loi de Mariotte :
-
À température constante et pour
une quantité donnée de gaz, le produit de la pression
P
par le volume V
occupé par le gaz est constant :
-
P . V = k
= constante.
-
La loi de Mariotte est un modèle
qui décrit correctement le comportement des gaz aux faibles pressions.
-
Pour les grandes pressions, il
existe d’autres modèles.
-
Schéma :

-
Schéma provenant d’un manuel de
plongée.
-
Il donne la pression de l’eau pour
quelques profondeurs.
-
La pression
P
est exprimée en bar et on donne la correspondance bar ↔ pascal
-
Il donne une relation permettant
de déterminer la pression en fonction de la profondeur.
-
La pression de l’eau s’ajoute à
celle de l’air.
-
On ajoute 1 bar tous les 10 m.
|
Pourquoi faut-il remonter
lentement ?
L’air est
constitué d’environ 20 % de dioxygène et de 80 % de diazote. Ces gaz sont solubles dans le sang. Au cours de la plongée, la pression qui s’exerce sur le plongeur augmente avec la profondeur. Il en est de même pour celle de l’air qu’il respire.
Cette augmentation de pression fait augmenter la
solubilité des gaz dans le sang.
Cela peut entraîner
plusieurs conséquences : Le dioxygène
devient toxique pour une pression supérieure à 1,6 bar, et le diazote
entraîne la narcose pour une pression supérieure à 5,6 bars. Cela limite la
profondeur pouvant être atteinte sans danger. Au cours d’une remontée, la pression diminue et les gaz dissous doivent être évacués. Le dioxygène est consommé par les cellules. Le diazote se vaporise et passe lentement dans les poumons. En cas de remontée rapide, le diazote n’a pas le temps de s’évacuer par les poumons, de grosses bulles apparaissent dans le sang. Elles peuvent boucher les vaisseaux sanguins et provoquer une embolie pulmonaire. Lors de la remontée, le plongeur doit respecter les
paliers de décompression. Quelle est
l’influence de la pression sur la solubilité d’un gaz dans un liquide et
quelles en sont les conséquences en plongée ?
|
-
La solubilité d’un gaz dans un
liquide augmente avec la pression.
-
Cela explique l’apparition de
bulles lors de l’ouverture d’une bouteille de boisson gazeuse.
-
Lors de l’ouverture la pression du gaz au-dessus du liquide diminue et devient égale à la
pression atmosphérique.
-
Comme la pression diminue, la
quantité de gaz dissous doit diminuer et des bulles apparaissent. Le gaz quitte
la boisson.
-
Dans les cas du plongeur, lors de
la remontée, la pression diminue et il se produit le même phénomène.
-
Il faut respecter les paliers de
décompression pour pouvoir éliminer l’excès de diazote dans les poumons et de
dioxygène.
-
Lors de la remontée du plongeur,
des bulles de gaz se forment dans le sang.
-
Elles sont éliminées par la
respiration si la remontée est lente.
-
En cas de remontée trop rapide,
elles peuvent se bloquer au niveau des veines, du cerveau ou du cœur.
-
C’est l’accident de
décompression.
-
Lors d’une plongée, le dioxygène
et le diazote de l’air sont d’autant plus dissous dans le sang que la pression
est importante.
-
Le dioxygène est consommé par le
corps humain.
-
Le diazote ne l’est pas. Il peut
se former des bulles dans le sang lors de la remontée.
-
Lors d’une remontée trop rapide,
la pression diminue brutalement et il se forme des bulles de gaz dans le sang.
-
Ces bulles peuvent bloquer la
circulation du sang et léser les organes vitaux.
-
Afin d’éviter la formation de
bulles, le plongeur doit remonter lentement et effectuer des paliers de décompression.
-
Extrait d’une table de la Marine nationale :
|
Plongée |
Paliers |
|||
|
Profondeur et
durée |
||||
|
Profondeur |
Durée |
9 m |
6 m |
3 m |
|
40 m |
10 min |
|
|
2 |
|
20 min |
|
1 |
9 |
|
|
30 min |
|
4 |
28 |
|
|
40 min |
|
13 |
40 |
|
|
50 min |
2 |
23 |
48 |
|
|
60 min |
8 |
29 |
57 |
|
Pour s'auto-évaluer
Les fluides au
repos. La force pressante.
La pression dans un fluide
incompressible au repos.
La pression dans un gaz au
repos.
|
1)-
Exercice 04 page 204 : Connaître la masse
volumique : 2)-
Exercice 06 page 204 :Décrire une
propriété des molécules. 3)-
Exercice 08 page 204 : Schématiser une
force pressante. 4)-
Exercice 10 page 204 : Force pressante,
pression et surface. 5)-
Exercice 11 page 205 : Calculer la valeur
d’une force pressante. 6)-
Exercice 13 page 205 : Étudier une force
pressante. 7)-
Exercice 16 page 205 : Déterminer une
différence de coordonnées verticales. 8)-
Exercice 19 page 205 : Lier pression d’un
gaz et volume. 9)-
Exercice 23 page 206 : Pression en plein
vol. 10)-
Exercice 24 page 206 : 11)-
DS N° 01 (30 min) : La manœuvre de
Valsalva : Exercice 37 page 2011 : 12)-
DS N° 02 (30 min): Le parachute de
palier : Exercice 38 page 211.
|
|
|