|
|
La mole Cours |
|
|
|
II-
Préparation d’une
solution. |
|
III-
Le dosage par étalonnage (TP).
1)- Absorbance d’une solution et sa mesure. 2)- Spectre d’absorption d’une solution aqueuse. |
|
La mole. La masse molaire.
La quantité de matière. La concentration en quantité de matière.
Le dosage par étalonnage
|
|
1)-
Exercice 03 page 26 :
Calculer un nombre de molécules. 2)-
Exercice 16 page 26 :
Élaborer un protocole de dilution. 3)-
Exercice 18 page 26 :
Compléter des relations. 4)-
Exercice 19 page 26 :
Calculer la concentration d’une solution fille. 5)-
Exercice 20 page 26 :
Exploiter les résultats d’un dosage. 6)-
Exercice 22 page 27 :
étudier une limite d’un dosage spectrophotométrique. 7)-
Exercice 25 page 28 :
Capsules de caféine. 8)-
Exercice 27 page 28 :
Glycémie à jeun. 9)-
Exercice 30 page 29 :
Solution commerciale d’éosine. 10)-
Exercice 31 page 29 :
Dilution d’un berlingot d’eau de Javel. 11)-
Exercice 36 page 31 :
L’eau oxygénée. 12)-
Exercice 32 page 31 :
L’eau de Dakin.
|
a)-
La mole :
-
La mole est la
réunion d'un nombre déterminé d’entités chimiques toutes identiques.
-
Une quantité de
référence a été choisie arbitrairement.
-
Elle est donnée par
le Journal officiel du 23 décembre 1975.
-
On note :
-
NA le nombre d’entités dans un paquet.
-
Un tel paquet porte
le nom de mole.
-
La mole est une
unité de quantité de matière de symbole : mol.
|
-
Définition : - La mole est la quantité de matière d'un système contenant
autant d'entités élémentaires qu'il y
a d'atomes dans |
-
Si l'on prend une mole d'atomes de
carbone 12, la masse correspondante est de
-
Le paquet comprend
NA atomes de carbone 12.
-
La détermination de
la valeur de
NA fut un grand défi pour la science.
-
Le nombre
NA représente le nombre
d’entités élémentaires par mol, on l’exprime en mol–1.
-
Des mesures
récentes indiquent qu’il y a : 6,022137 ×
1023 atomes de carbone 12
dans
-
On arrondit cette valeur. On écrit :
-
NA = 6,02 ×
1023 mol–1.
-
Exemples :
-
Une mole d’atomes
de fer contient 6,02
x
1023 atomes de fer.
-
Une mole de
molécules d’eau contient 6,02 ×
1023
molécules
d’eau.
-
Une mole
d’électrons contient 6,02 ×
1023
électrons
-
Une mole d’ions
chlorure contient 6,02 ×
1023
ions
chlorure.
b)-
La quantité de matière.
-
La quantité de matière
d’une espèce chimique ne se mesure pas, elle se détermine grâce à d’autres
grandeurs physiques qui elles se mesurent.
-
La
quantité de matière n est la grandeur utilisée pour
dénombrer les entités (atomes, molécules, ions, …)
-
Elle s’exprime en mol.
|
Ou
N
= n . NA |
n
: quantité de matière (mol) |
|
N :
nombre d’entités (sans unité) |
|
|
NA :
constante d’Avogadro :
NA
= 6,02
× 1023
mol–1 |
-
Ainsi
-
6,02 ×
1023 atomes de fer = 1
mole de fer
-
6,02 ×
1023
molécules
d’eau = 1 mole d’eau
-
6,02 ×
1023
électrons
= 1 mole d’électrons.
a)-
Définition générale :
-
La masse molaire
d’une espèce chimique est la masse d’une mole de cette espèce chimique.
-
On symbolise la masse molaire par
M.
-
La masse molaire s’exprime en g . mol–1.
b)-
Masse molaire atomique.
-
La masse molaire
atomique est la masse d'une mole d'atomes de l'espèce considérée.
-
Dans la
classification périodique, on donne les masses molaires atomiques des éléments
chimiques en tenant compte des proportions naturelles de ses isotopes.
-
Masse molaire
atomique de l'élément carbone :
-
M(C)
= 12,0 g . mol–1.
-
Masse molaire
atomique de l'élément oxygène :
-
M(O)
= 16,0 g . mol–1.
-
Masse molaire
atomique de l'élément cuivre :
-
M(Cu)
= 63,5 g . mol–1.
-
Masse molaire
atomique de l'élément cuivre :
-
M(Cl)
= 35,5 g . mol–1.
-
Dans la nature, il
y a 75 % de l’isotope 35 et 25 % de l’isotope 37.
c)-
La masse molaire moléculaire.
-
La masse molaire
moléculaire est la masse d'une mole de molécules de l'espèce considérée.
-
La masse molaire
moléculaire s'obtient en faisant la somme des masses molaires atomiques des
atomes qui constituent la molécule.
-
Exemples :
-
déterminer
la masse molaire moléculaire des espèces chimiques suivantes :
-
H2O
; Cℓ2
; H2SO4
et NH3.
-
Masse molaire de la
molécule d'eau :
-
M
(H2O) = 2
M(O)
+
M
(H)
-
M
(H2O) = 2 ×
16,0 + 1 ×
1,0
-
M (H2O)
≈ 18,0 g . mol–1
-
Masse molaire du
dichlore :
-
M
(Cℓ2)
= 2
M(Cℓ)
-
M
(Cℓ2)
= 2 ×
35,5
-
M
(Cℓ2)
≈ 70,0
g . mol–1
-
Masse molaire de
l'acide sulfurique :
-
M (H2SO4)
= 2
M(H)
+
M (S)
+ 4
M(O)
-
M
(H2SO4)
= 2 ×
1,0 + 1 ×
32,1 + 4 ×
16,0
-
M
(H2SO4)
≈ 98,1
g . mol–1.
-
Masse molaire de
l'ammoniac :
-
M
(NH3)
=
M(N) + 3
M (H)
-
M
(NH3)
= 1 ×
14,0 + 3 ×
1,0
-
M
(NH3)
≈ 17,0
g . mol–1
d)-
Masse molaire ionique.
-
La masse molaire
ionique est la masse d'une mole d'ions de l'espèce considérée.
-
On peut négliger la
masse des électrons devant la masse du noyau d'un atome.
-
La masse molaire
d'un ion monoatomique est pratiquement égale à celle de l'atome correspondant.
-
Exemples :
-
M
(Na+)
≈
M
(Na)
-
M
(Cl–)
≈
M
(Cl)
-
Pour déterminer la
masse molaire d'un ion polyatomique, on fait comme pour les molécules.
-
Masse molaire de
l'ion phosphate :
PO43– :
-
M
(PO43–)
= M
(P) + 3
M (O)
-
M
(PO43–)
= 1 ×
31,0 + 4 ×
16,0
-
M
(PO43–)
≈ 95,0
g . mol–1
-
Masse molaire de
l'ion sulfate SO42– :
-
M (SO42–)
=
M (S)
+ 4
M
(O)
-
M
(SO42–)
= 1 ×
32,1 + 4 ×
16,0
-
M
(SO42–)
≈ 96,1
g . mol–1.
3)- Masse molaire et quantité de matière.
a)-
Application 1.
-
Calculer la quantité de matière
contenue dans
-
Résolution :
-
Le fer métal a une
structure atomique,
-
il faut utiliser la
masse molaire atomique de l'élément fer
-
Dans les tables :
M
(Fe) ≈ 55,8 g . mol–1
≈ 55 g . mol–1.
-
À 1 mole de fer métal correspond
environ
-
À 1/2 mole de fer métal correspond
environ
-
On va utiliser un
formalisme mathématique pour pouvoir résoudre tous les exercices du même type :
-
Écriture symbolique
:
-
Quantité de matière de l'espèce chimique considérée :
-
n
en
mol
-
Masse molaire de l'espèce chimique considérée :
-
M
en
g . mol–1
-
Masse de l'espèce chimique considérée :
-
m
en
g
-
Relations :
|
|
n
: quantité de matière de l’espèce chimique (mol) |
|
m :
masse de l’espèce chimique (g) |
|
|
M :
masse molaire de l’espèce chimique (g . mol–1) |
-
Remarque :
-
Toutefois, il faut
adapter l’écriture de la relation aux notations de l’énoncé de la question.
-
Calculer la quantité de matière
n contenue dans la masse m =
-
- Quantité de matière de fer :
-
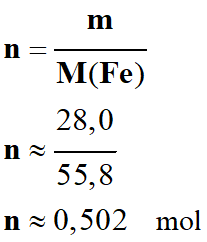
-
Il faut adapter
l’écriture de la relation aux notations de l’énoncé de la question
b)-
application
2.
-
calculer la
masse de 0,500 mol de soufre
-
Données : M (S)
= 32,1 g . mol–1 et
n
(S)
=
0,500 mol.
-
On cherche m
(S).
-
Masse de soufre
correspondant.
-
m (S)
=
n
(S) .
M
(S)
-
m (S)
= 0,500 ×
32,1
-
m (S)
≈ 16,1 g
c)-
application
3
-
calculer
la quantité de matière d'eau n1
contenue dans un litre d'eau.
-
On donne : la masse d’un litre d'eau est
m1
=
-
L'eau a une structure moléculaire de formule
H2O.
-
Masse molaire de la
molécule d'eau :
-
M
(H2O) = 2
M(O)
+
M
(H)
-
M
(H2O) = 2 ×
16,0 + 1 ×
1,0
-
M (H2O)
≈ 18,0 g . mol–1
-
Quantité de matière
contenue dans un litre d'eau :
-
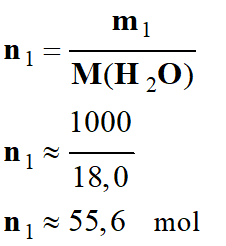
a)-
Gaz et quantité de matière.
-
La relation :
|
|
n
: quantité de matière de l’espèce chimique (mol) |
|
m :
masse de l’espèce chimique (g) |
|
|
M :
masse molaire de l’espèce chimique (g . mol–1) |
-
est valable pour
les solides, les liquides et les gaz.
-
Il est plus facile
de mesurer le volume d’un gaz que sa masse.
b)-
Loi d’Avogadro – Ampère.
|
Énoncé :
des
volumes égaux de gaz différents,
pris dans les mêmes conditions de température et de pression,
renferment le même nombre de molécules.
|
-
En conséquence, des
volumes égaux de gaz différents, pris dans les mêmes conditions de température
et de pression, renferment le même nombre de moles.
-
Si l’on prend
-
D’autre part, une
mole de dihydrogène, une mole de butane, une mole de méthane occupent le même
volume dans les mêmes conditions de température et de pression.
-
Ce volume est
appelé, le volume molaire.
-
Le volume molaire
d’un gaz est indépendant de la nature du gaz.
-
Il dépend de la
température et de la pression.
-
On note
Vm le volume molaire d’un gaz.
-
L’unité : (L . mol–1)
-
Quelques valeurs du
volume molaire :
|
Température
° C |
Pression
Pa |
Volume molaire
L . mol–1 |
|
|
O |
1,013 × 105 |
22,4 |
C.N.T.P |
|
20 |
1,013 × 105 |
24,0 |
|
|
20 |
10,13 × 105 |
2,40 |
|
-
Quantité de matière n d’un volume
V
de gaz :
-
La relation
(valable pour les gaz seulement) :
|
|
n
: quantité de matière de l’espèce chimique (mol) |
|
V :
volume de l’espèce chimique gazeuse (L) |
|
|
Vm :
Volume molaire de l’espèce chimique gazeuse (L . mol–1) |
5)- La concentration en quantité de matière
(autrefois concentration molaire volumique ou plus simplement
concentration molaire).
a)-
La concentration en quantité
de matière.
|
- La concentration en quantité de matière C d’une espèce chimique en solution est le quotient de la quantité de matière n de soluté
par le volume Vsolution
de la solution. |
-
Relation :
|
Ou n
= C . Vsolution |
C :
concentration en quantité de matière (mol . L –1) |
|
n
: quantité de matière de l’espèce chimique (mol) |
|
|
Vsolution :
Volume molaire de l’espèce chimique gazeuse (L) |
-
Autre relation :
-
n
= C
. Vsolution
b)-
Relation entre
la concentration en quantité de matière
C et la concentration en masse
t :
-
La concentration en
masse, ou titre massique, t
d’une solution en espèce chimique dissoute est le
quotient de la masse msoluté
de soluté par le volume Vsolution
de la solution.
-
Relation :
|
|
t
concentration en masse en
soluté en g / L
msoluté
masse de soluté en g.
Vsolution
volume de la solution en L. |
-
Avec
-
msoluté
= n
. M et
n
= C
. Vsolution
-
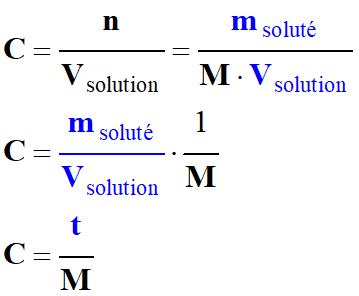
-
Relation :
|
|
C :
concentration en quantité de matière (mol . L –1) |
|
t
: concentration en masse (g. L –1) |
|
|
M :
masse molaire de l’espèce chimique (g. mol –1) |
II-
Préparation d’une
solution.
1)- La dissolution (vu en seconde).
-
On souhaite préparer
un volume V = 100 mL d’une solution aqueuse de
glucose de concentration en masse
t = 18,0 g
. L–1 à partir de glucose
solide.
| Protocole | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-
Connaissant la concentration en masse
t
de la solution, on peut en déduire la concentration en quantité de matière
C.
-
Pour ce faire, il faut
connaître la masse molaire du glucose.
-
M
(C6H12O6)
= 180 g . mol–1.
-
Volume
de la solution : V = 100 mL
-
Concentration en masse
de la solution :
t = 18,0 g
. L–1
-
Masse de soluté
nécessaire :
-
m
=
t
. V
-
m
= 18,0 × 100 × 10–3
-
m
≈ 1,80 g
-
Quantité de matière de
soluté :
- 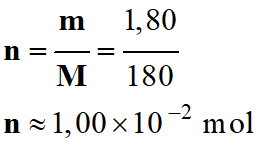
-
Concentration en
quantité de matière de la solution :
- 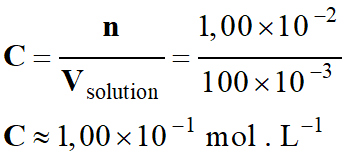
-
On peut
utiliser une autre méthode car on connaît la concentration en masse
t :
- 
-
De
façon générale, pour préparer une solution de volume
V
à la concentration
C en espèce chimique, il faut prélever puis dissoudre
une masse m
telle que :
-
m
=
n
. M
= C .
Vsolution
. M
2)- La dilution (vu en seconde).
-
La dilution d’une
solution aqueuse est l’ajout d’eau à cette solution.
-
La solution aqueuse
obtenue (solution fille) est moins concentrée que la solution initiale (solution
mère).
-
Protocole :
|
Verser suffisamment de solution Mère dans un bécher |
Deuxième étape : On prélève le volume nécessaire de solution Mère à l’aide d’une pipette jaugée munie de sa propipette |
Troisième étape : On verse le volume nécessaire de solution dans la fiole jaugée de volume approprié.. |
|
On ne pipette jamais directement dans le flacon qui contient
la solution
Mère |
|
|
|
Quatrième étape : On ajoute de l’eau distillée et on agite mélanger et homogénéiser |
Cinquième étape : On complète avec une pissette d’eau distillée jusqu’au trait de jauge. |
Sixième étape : on agite pour homogénéiser. La solution est prête. |
|
|
|
|
-
Dilution et
concentration en quantité de matière :
-
Lors d’une dilution,
la concentration en quantité de matière du soluté diminue, mais sa
quantité de matière ne change pas.
-
On dit qu’au cours
d’une dilution, la quantité de matière de soluté se conserve.
-
La solution de départ
est appelée la solution mère et la solution diluée est appelée la solution
fille.
|
|
Cm |
Dilution |
|
Cf |
|
Solution mère |
|
→ |
Solution fille |
|
|
|
Vm |
|
|
Vf |
-
La quantité de matière
de soluté est la même
dans la solution mère et dans la solution fille.
-
Il y a conservation de
la quantité de matière de soluté :
-
la
quantité de matière de soluté présente dans la solution mère :
-
nm
= Cm
. Vm
(1)
-
la
quantité de matière de soluté présente dans la solution fille :
-
nf
= Cf
. Vf
(2)
-
Or nm
= nf
-
Cm
. Vm
=
Cf
. Vf
(3)
-
Le facteur de dilution
est donné par la relation suivante :
-

III-
Le dosage par étalonnage (TP).
1)- Absorbance d’une solution et sa mesure.
a)-
Absorbance d’une solution :
-
La proportion de
lumière absorbée par une solution colorée, à une longueur d’onde
λ donnée,
représente son absorbance notée A.
-
C’est une grandeur qui
n’a pas d’unité.
-
C’est une grandeur
additive : l’absorbance d’une solution est la somme des absorbances de toutes
les espèces présentes dans la solution.
b)-
Mesure de l’absorbance.
-
On utilise le fait que toute solution colorée absorbe
la lumière visible (400 nm < λ0
< 800 nm).
-
Lorsqu’un faisceau de lumière monochromatique
traverse un milieu absorbant, l’intensité lumineuse
I du faisceau
transmis est inférieure à l’intensité lumineuse
I0
du faisceau incident.
-
Pour mesurer
l’absorbance, on utilise un spectrophotomètre.
-
Un
système dispersif (prisme ou réseau) permet de sélectionner une radiation
lumineuse de longueur d’onde λ donnée.
-
Cette radiation est
dirigée vers l’échantillon à analyser.
-
Le flux lumineux
transmis est mesuré et converti en valeur d’absorbance.
-
L’appareil affiche la
valeur de l’absorbance qui est un nombre sans unité compris entre 0 et 2.
2)- Spectre d’absorption d’une solution aqueuse :
Absorbance en fonction de la longueur d’onde.
a)-
Mode opératoire :
-
L’absorbance d’une
solution colorée dépend de la longueur d’onde de la radiation lumineuse
utilisée.
-
Exemple :
-
On donne
l’absorbance d’une solution de diiode
I2
(aq) en fonction de la longueur d’onde
λ :
-
Pour une solution de diiode de concentration
C = 1,0
mmol / L,
on mesure l’absorbance A
pour différentes longueurs d’ondes.
-
La plage de
variation de la longueur d’onde se situe dans l’intervalle suivant :
-
400 nm < λ
< 700 nm.
-
On règle la
longueur d’onde sur la valeur souhaitée, on « fait
le blanc »
avec la solution étalon, puis on mesure l’absorbance.
-
« Faire le blanc » :
avant toute mesure d’absorbance, il faut régler le « zéro » d’absorbance afin de
mesurer uniquement l’absorbance due à l’espèce colorée et non pas celle de la
cuve et du solvant.
-
Il faut répéter le
mode opératoire pour chaque mesure.
-
Cette manipulation est
longue, mais elle est effectuée une fois pour toute.
b)-
Courbe obtenue :
-
Absorbance d’une
solution de diiode en fonction de la longueur d’onde :
-
Solution de diiode de
concentration C
(I2) =
1,0
mmol . L–1
-
La solution absorbe
principalement dans le bleu et un peu dans le vert.
-
L’étude du spectre permet de déterminer la longueur
d’onde λmax
pour laquelle l’absorbance est maximale.
-
Dans le cas de la
solution aqueuse de
diiode,
λmax
≈ 475 nm
c)-
Couleur de la solution
aqueuse
-
Si la solution
n’absorbe que dans un seul domaine de longueurs d’onde du visible, sa couleur
peut être obtenue grâce au cercle chromatique.
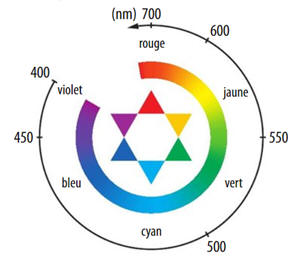
-
La couleur de la
solution est la couleur complémentaire, opposée dans le cercle chromatique
-
Comme la solution de
diiode absorbe principalement dans le bleu (et un peu dans le vert), la couleur
complémentaire, opposée dans le cercle chromatique : domaine jaune.
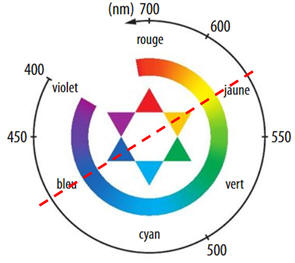
3)- Absorbance en fonction de la concentration : Loi de
Beer-Lambert.
a)-
Réglage du spectrophotomètre.
-
Pour réaliser les
mesures d’absorbance, le spectrophotomètre est généralement réglé sur la
longueur d’onde
λmax
correspondant au maximum d’absorption du spectre de la solution étudiée.
-
À cette longueur
d’onde, la valeur de l’absorbance étant la plus grande, l’incertitude sur la
mesure est la plus petite.
-
Pour les solutions
aqueuses de diiode, on choisit λ
= 450 nm, pour avoir le maximum de variations pour la valeur de
A.
-
On n’a pas choisi
λ = 475 nm car
le spectrophotomètre sature en fin d’expérience lorsque la concentration en
diiode devient trop grande (C0 = 1,0 mmol / L).
b)-
Préparation des solutions et
mesures :
-
On dispose d’une solution
S0
de concentration en diiode C0
= 1,0 mmol / L.
-
À partir de S0,
préparer les solutions 10 mL de solution
S en utilisant les
solutions présentes dans les burettes.
-
Matériel :
-
Préparer la solution
S et réaliser la
mesure de l’absorbance de la solution préparée.
-
Mesures réalisées lors
d’une séance de travaux pratiques
|
Groupes |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Solution S
mmol / L |
0,10 |
0,20 |
0,30 |
0,40 |
0,50 |
0,60 |
0,70 |
0,80 |
0,90 |
1,00 |
|
Absorbance A G1 |
0.120 |
0.256 |
0.435 |
0.578 |
0.723 |
0.818 |
0.997 |
1.149 |
1.281 |
1.404 |
|
Absorbance A G2 |
0.096 |
0.228 |
0.361 |
0.508 |
0.628 |
0.723 |
0.878 |
1.053 |
1.109 |
1.261 |
-
Pour préparer la solution
S, on mélange la
solution de diiode de concentration C0
= 1,0 mmol / L et la solution d’iodure de potassium de concentration
C = 0,20 mol
/ L.
-
Pour préparer la solution
1, on mélange à
l’aide des burettes graduées, 1,0 mL de solution de diiode de concentration
C0
= 1,0 mmol / L et 9,0 mL de solution d’iodure de potassium de concentration
C = 0,20 mol / L.
-
Pour préparer la solution
2, on mélange à
l’aide des burettes graduées, 2,0 mL de solution de diiode de concentration
C0
= 1,0 mmol / L et 8,0 mL de solution d’iodure de potassium de concentration
C = 0,20 mol / L.
-
Ainsi de suite….
c)-
Exploitation des mesures.
-
On trace la courbe
A
= f (C).
-
Courbe
obtenu par le Groupe G1 :
-
On obtient la courbe
d’étalonnage.
-
Ce graphe est une
portion de droite passant par l’origine.
-
L’absorbance
A est
proportionnelle à la concentration C
de la solution de diiode.
-
A
= k
. C.
-
Pour le
groupe G1 :
A
≈ 1,43 C
(mmol / L)
-
Pour le
groupe G2 :
A
≈ 1,28 C
(mmol / L)
-
On peut généraliser ce
résultat à toutes les solutions colorées.
-
Pour les solutions
suffisamment diluées, l’absorbance est proportionnelle à la concentration de
l’espèce
colorée.
►
Définition :
|
►
Définition : - L’absorbance d’une solution diluée contenant une espèce colorée est proportionnelle à la concentration (effective) C de cette espèce
et à l’épaisseur
ℓ
(cm) de la solution traversée par le faisceau lumineux.
-
A
(λ) =
ε (λ)
. ℓ .
C
-
ε
(λ) est
appelé coefficient d’extinction molaire ou coefficient d’absorption molaire.
|
||||||||
|
-
Remarque :
-
Pour le groupe
G1 :
A
≈ 1,43 C
(mmol / L)
-
Pour le groupe
G2 :
A
≈ 1,28 C
(mmol / L)
-
Avec : A
(λ) = ε (λ) . ℓ .
C
-
ε (λ)
est appelé coefficient
d’extinction molaire ou coefficient d’absorption molaire.
-
Il dépend de
la nature de l’espèce dissoute et de la longueur d’onde de la
radiation utilisée.
-
Il dépend également
du solvant et de la température. (mol
– 1 . L . cm – 1).
-
Groupe
G1 :
ε (450) ≈ 1,43 × 103
mol
– 1 . L . cm – 1
-
ou groupe
G2 :
ε (450) ≈ 1,28 × 103
mol
– 1. L . cm – 1
-
Valeur donnée
par les tables :
-
La valeur du
coefficient ε dépend de la longueur d’onde λ.
-
Pour λ = 450
nm, ε (450) = 1,436 x
10 3 mol
– 1 . L . cm
– 1
-
Il y a un problème pour le groupe
G2,
la valeur trouvée pour de ε (λ)
est faible.
|
-
Utilisation :
-
La courbe
A
= f
(C)
constitue la courbe d’étalonnage de la substance étudiée.
-
Elle permet de déterminer la concentration d’une solution de la substance
étudiée.
-
Elle permet donc de
doser une espèce chimique colorée.
-
Afin d’augmenter la sensibilité de la méthode, on utilise la longueur d’onde qui
correspond au maximum d’absorption de la substance étudiée.
-
Cette méthode est alors beaucoup plus précise que la méthode colorimétrique
utilisant une échelle des teintes.
-
Un dosage par
étalonnage consiste à déterminer la concentration en espèce chimique dans une
solution en comparant une grandeur physique caractéristique de cette solution
(par exemple l’absorbance) à celles de solutions étalons.
-
La
concentration Cinconnue
en espèce colorée d’une solution
S se détermine par lecture graphique
depuis la courbe d’étalonnage
A =
f (C)
tracée à partir des absorbances de solutions étalons.
-
Étape 1 :
on prépare une gamme de solutions de différentes concentrations
C
connues en espèce colorée. Elles sont préparées
par dilution à partir d’une solution mère.
-
Étape 2 :
on mesure l’absorbance des solutions étalons.
-
Étape 3 :
on trace la courbe d’étalonnage
A =
f
(C).
-
Étape 4 :
on mesure l’absorbance
A de la solution
S
et on détermine graphiquement la concentration Cinconnue
de la solution S
en espèce colorée.
-
Limite de la méthode :
-
La loi de Beer-Lambert
ne peut pas être utilisée pour le solutions trop concentrées.
-
Application :
-
L’absorbance d’une solution de diiode est
A
= 0,75.
-
En
déduire la valeur de la concentration
Cinc
de cette solution pour la courbe obtenue
par
le groupe G1
précédemment.
-
Exploitation avec la courbe du groupe
G1 :
-
On
repère le point d’ordonnée
A = 0,75
-
Puis on
recherche l’antécédent de
A = 0,75.
-
La
concentration en diiode de la solution est voisine de :
-
Cinc
≈ 0,52 mmol / L.
La mole. La masse
molaire. La quantité de matière.
La concentration
en quantité de matière. Le dosage par étalonnage
|
1)-
Exercice 03 page 26 :
Calculer un nombre de molécules. 2)-
Exercice 16 page 26 :
Élaborer un protocole de dilution. 3)-
Exercice 18 page 26 :
Compléter des relations. 4)-
Exercice 19 page 26 :
Calculer la concentration d’une solution fille. 5)-
Exercice 20 page 26 :
Exploiter les résultats d’un dosage. 6)-
Exercice 22 page 27 :
étudier une limite d’un dosage spectrophotométrique. 7)-
Exercice 25 page 28 :
Capsules de caféine. 8)-
Exercice 27 page 28 :
Glycémie à jeun. 9)-
Exercice 30 page 29 :
Solution commerciale d’éosine. 10)-
Exercice 31 page 29 :
Dilution d’un berlingot d’eau de Javel. 11)-
Exercice 36 page 31 :
L’eau oxygénée. 12)-
Exercice 32 page 31 :
L’eau de Dakin.
|
|
|