|
La mole |
|
|
|
|
|
|
La mole. La masse
molaire. La quantité de matière. La concentration en quantité de matière. Le dosage par étalonnage |
|
QCM N° 01
La mole. La masse
molaire. La quantité de matière.
La concentration
en quantité de matière. Le dosage par étalonnage |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Une mole
représente : |
6,02 × 1023
entités |
6,02 × 1023
g |
6,02 × 10–
23
entités |
A |
|
2 |
Une solution
aqueuse : |
Est un
corps pur |
Est un
mélange. |
N’est
constituée
que d’eau |
B |
|
3 |
Pour préparer
500,0 mL d’une solution
à 2,00 g . L–1 en sulfate de
cuivre, la masse m
à prélever est : |
m
= 1,00 g |
m
= 4,00 g |
m
= 0,25 g |
A |
|
4 |
Une solution
S est diluée. La solution
S’ obtenue contient : |
Plus de
soluté que
la solution S. |
Moins de
soluté que
la solution S. |
Autant de
soluté que
la solution S. |
C |
|
5 |
La masse molaire moléculaire représente
la
masse : |
D’une mole
de molécules. |
De 6,02 × 1023
molécules |
D’une
molécule |
AB |
|
6 |
La masse
molaire atomique du sodium
Na relevée dans le tableau
périodique est : |
M = 11,0
mol . g–1 |
M = 23,0
g . mol –1 |
M = 11,0
g . mol –1 |
B |
|
7 |
La masse molaire moléculaire du dioxyde de
carbone CO2 est égale à :
|
2 × M (C)
+ 2 M (O) |
M (C)
+ 2 M (O) |
M
(C)
+ M (O) |
B |
|
8 |
Sachant que le
volume molaire d’un
gaz à 20 ° C et 1013 hPa
est Vm
= 24,0 L. mol–1, le volume occupé par 2 mol de dioxygène O2 est : |
V
= 48,0 L |
V
= 12,0 L |
V
= 24,0 L |
A |
|
9 |
La quantité de
matière n, la masse m
et la masse
molaire M sont liées
par : |
n
= m . M |
|
|
C |
|
10 |
La masse à
prélever pour obtenir n
= 2,00 mol de cuivre de
masse molaire
atomique M
(Cu) = 63,5 g . mol –1
est : |
m
= 32,0 g |
m
= 127 g |
m
= 63,5 g |
B |
|
11 |
La concentration en quantité de matière C d’une espèce chimique en
solution s’écrit : |
|
C
= n . Vsolution |
|
A |
|
12 |
La
concentration en quantité de matière
C et la concentration
en masse t d’une espèce
chimique sont liées
par : |
|
C
= M . t |
C
. M = t |
AC |
|
13 |
Un volume V = 30 mL d’une solution aqueuse contient n = 0,060 mol de glucose.La concentration en glucose de la solution
est égale à : |
C
= 0,50
mol . L–1 |
C
= 2,0 × 10–3
mol . L–1 |
C
= 2,0
mol . L–1 |
C |
|
14 |
Le
spectrophotomètre mesure :
|
L’absorbance
d’une
solution |
La
concentration
d’une espèce en
solution |
La
couleur d’une
solution |
A |
|
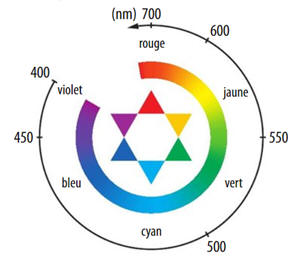
15 |
Le spectre
d’absorption d’une solution
présente un maximum
d’absorption à la longueur
d’onde λmax =
460 nm. La couleur de la solution
déterminée à l’aide du
cercle chromatique
ci-dessous est : |
Bleue. |
Orange. |
Incolore. |
B |
|
16 |
On trace la
courbe d’étalonnage
ci-dessous. L’absorbance d’une solution est A = 0,5. La concentration en espèce colorée de cette solution est :
|
C
= 0,050
mol . L–1 |
C
= 0,50
mol . L–1 |
C
= 0,025
mol . L–1 |
C |
QCM réalisé avec le logiciel QUESTY
La mole. La masse molaire.
La quantité de matière.
La concentration en quantité de matière.
Le dosage par étalonnage
Pour s’auto-évaluer
Aide :
La mole :
|
-
Définition : - La mole est la quantité de matière d'un système contenant
autant d'entités élémentaires qu'il y
a d'atomes dans |
La quantité de matière :
-
La
quantité de matière n est la grandeur utilisée pour
dénombrer les entités (atomes, molécules, ions, …)
-
Elle s’exprime en mol.
|
|
n
: quantité de matière (mol) |
|
N :
nombre d’entités (sans unité) |
|
|
NA :
constante d’Avogadro :
NA
= 6,02
× 1023
mol–1 |
La masse molaire :
-
Définition générale :
-
La masse molaire
d’une espèce chimique est la masse d’une mole de cette espèce chimique.
-
On symbolise la masse molaire par
M.
-
La masse molaire s’exprime en g . mol–1.
Masse molaire
atomique.
-
La masse molaire
atomique est la masse d'une mole d'atomes de l'espèce considérée.
-
Dans la
classification périodique, on donne les masses molaires atomiques des éléments
chimiques en tenant compte des proportions naturelles de ses isotopes.
La masse molaire
moléculaire.
-
La masse molaire
moléculaire est la masse d'une mole de molécules de l'espèce considérée.
-
La masse molaire
moléculaire s'obtient en faisant la somme des masses molaires atomiques des
atomes qui constituent la molécule.
Masse molaire
ionique.
-
La masse molaire
ionique est la masse d'une mole d'ions de l'espèce considérée.
-
On peut négliger la
masse des électrons devant la masse du noyau d'un atome.
-
La masse molaire
d'un ion monoatomique est pratiquement égale à celle de l'atome correspondant.
Quantité de matière :
-
Relation :
|
Ou
m
= n . M |
n
: quantité de matière de l’espèce chimique (mol) |
|
m :
masse de l’espèce chimique (g) |
|
|
M :
masse molaire de l’espèce chimique (g . mol–1) |
Gaz et quantité de matière :
-
Quantité de matière
n d’un volume
V
de gaz :
-
La relation
(valable pour les gaz seulement) :
|
|
n
: quantité de matière de l’espèce chimique (mol) |
|
V :
volume de l’espèce chimique gazeuse (L) |
|
|
Vm :
Volume molaire de l’espèce chimique gazeuse (L . mol–1) |
-
Quelques valeurs du
volume molaire :
|
Température
° C |
Pression
Pa |
Volume molaire
L . mol–1 |
|
|
O |
1,013 × 105 |
22,4 |
C.N.T.P |
|
20 |
1,013 × 105 |
24,0 |
|
|
20 |
10,13 × 105 |
2,40 |
|
La concentration en quantité de matière.
|
- La concentration en quantité de matière C d’une espèce chimique en solution est le quotient de la quantité de matière n de soluté
par le volume
Vsolution de
la solution. |
- Relation :
|
Ou n
= C . Vsolution |
C :
concentration en quantité de matière (mol . L –1) |
|
n
: quantité de matière de l’espèce chimique (mol) |
|
|
Vsolution :
Volume molaire de l’espèce chimique gazeuse (L) |
Concentration en masse
t :
|
-
La concentration en
masse, ou titre massique, t
d’une solution |
-
Relation :
|
|
t
concentration en masse en
soluté en g / L
msoluté
masse de soluté en g.
Vsolution
volume de la solution en L. |
Relation entre concentration en masse et concentration
en quantité de matière :
-
Relation :
|
|
C :
concentration en quantité de matière (mol . L –1) |
|
t
: concentration en masse (g. L –1) |
|
|
M :
masse molaire de l’espèce chimique (g. mol –1) |
Préparation des solutions :
-
Dissolution :
| Protocole | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-
Dilution :
|
Verser suffisamment de solution Mère dans un bécher |
Deuxième étape : On prélève le volume nécessaire de solution Mère à l’aide d’une pipette jaugée munie de sa propipette |
Troisième étape : On verse le volume nécessaire de solution dans la fiole jaugée de volume approprié.. |
|
On ne pipette jamais directement dans le flacon qui contient
la solution
Mère |
|
|
|
Quatrième étape : On ajoute de l’eau distillée et on agite mélanger et homogénéiser |
Cinquième étape : On complète avec une pissette d’eau distillée jusqu’au trait de jauge. |
Sixième étape : on agite pour homogénéiser. La solution est prête. |
|
|
|
|
-
Dilution et
concentration en quantité de matière :
-
Lors d’une dilution,
la concentration en quantité de matière du soluté diminue, mais sa
quantité de matière ne change pas.
-
On dit qu’au cours
d’une dilution, la quantité de matière de soluté se conserve.
-
La solution de départ
est appelée la solution mère et la solution diluée est appelée la solution
fille.
|
|
Cm |
Dilution |
|
Cf |
|
Solution mère |
|
→ |
Solution fille |
|
|
|
Vm |
|
|
Vf |
-
La quantité de matière
de soluté est la même
dans la solution mère et dans la solution fille.
Facteur de dilution :
-

Absorbance d’une solution :
-
L’absorbance d’une
solution se mesure à l’aide d’un spectrophotomètre :

-
Absorbance en fonction
de la longueur d’onde.
-
Cas d’une solution de
diiode :
-
Absorbance en fonction
de la concentration
-
Loi de Beer-Lambert :
|
-
L’absorbance d’une solution diluée
contenant une espèce colorée est
proportionnelle à la concentration (effective)
C
de cette espèce
et à
l’épaisseur
ℓ
(cm) de la solution traversée par le faisceau lumineux. -
A
(λ)
= ε (λ)
. ℓ . C -
ε
(λ)
est appelé coefficient d’extinction molaire ou coefficient
d’absorption molaire.
|
||||||||
Le dosage par étalonnage :
-
Un dosage par
étalonnage consiste à déterminer la concentration en espèce chimique dans une
solution en comparant une grandeur physique caractéristique de cette solution
(par exemple l’absorbance) à celles de solutions étalons.
-
La
concentration Cinconnue
en espèce colorée d’une solution
S se détermine par lecture graphique
depuis la courbe d’étalonnage A =
f
(C)
tracée à partir des absorbances de solutions étalons.
-
Étape 1 :
on prépare une gamme de solutions de différentes concentrations
C
connues en espèce colorée. Elles sont préparées
par dilution à partir d’une solution mère.
-
Étape 2 :
on mesure l’absorbance des solutions étalons.
-
Étape 3 :
on trace la courbe d’étalonnage
A =
f
(C).
-
Étape 4 :
on mesure l’absorbance
A de la solution
S
et on détermine graphiquement la concentration Cinconnue
de la solution S
en espèce colorée.
-
Exploitation avec la courbe
A =
f
(C).
:
-
On
repère le point d’ordonnée
A =
-
Puis on
recherche l’antécédent de
A =
-
On en
déduit la valeur de C par lecture graphique.
-
Limite de la méthode :
-
La loi de Beer-Lambert
ne peut pas être utilisée pour le solutions trop concentrées.
Cercle chromatique :
|
|