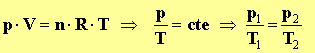-

-
-
-
2)- Exercice 14 page 163.
-
Le
sodium réagit avec l’eau. Il se forme des ions sodium
Na+,
des ions hydroxyde
HO-
ainsi que du dihydrogène.
-
a)-
Écrire l’équation chimique correspondant à cette réaction et vérifier
que les nombres stœchiométriques sont ajustés (attention aux charges des
ions).
-
2 Na
(s) +
2 H2O
(ℓ)
→
2 Na
+
(aq) + 2 HO
-
(aq) +
H2 (g)
-
b)-
cette réaction dangereuse est effectuée avec 0,23 g de sodium seulement,
que l’on introduit dans 1,0 L d’eau.
-
-
Quelles sont les quantités de matière (en mol) de sodium et d’eau
mises en jeu ?
-
-
Quantité de matière de sodium mise en jeu :
|
|
|
m
(Na) |
|
|
|
n
(Na)
=
|
|
|
| |
|
M
(Na) |
|
| |
|
|
|
| |
|
0,23 |
|
| |
n
(Na)
=
|
|
|
| |
|
23,0 |
|
| |
|
|
|
| |
n
(Na)
≈
1,0
×
10 -
2
mol
|
-
-
-
Quantité de matière d’eau mise en jeu :
|
|
|
m
(H2O) |
|
|
|
n
(H2O)
=
|
|
|
| |
|
M
(H2O) |
|
| |
|
|
|
| |
|
1,0
× 10 3 |
|
| |
n
(H2O)
=
|
|
|
| |
|
18,0 |
|
| |
|
|
|
| |
n
(H2O)
≈
56
mol
|
-
-
c)-
dresser un tableau
d’avancement pour cette réaction et en déduire le réactif limitant.
-
-
Tableau d’avancement :
-
-
On peut considérer que la quantité de matière d’eau n’a pratiquement
pas varié.
-
-
La quantité
de matière d’eau à l’état final :
-
-
Le volume de la solution est voisin de 1 L.
-
e)-
Caractériser complètement l’état final (en volume pour le gaz et
en concentration pour les ions).
-
-
Volume de dihydrogène formé :
-
-
V
(H2)
= n
(H2)
. Vm
-
-
V
(H2)
=
5,0
×
10
- 3
×
24
-
-
V
(H2)
≈
0,12 L
-
 Concentration
des ions présents dans la solution :
Concentration
des ions présents dans la solution :
|
|
|
n
(Na
+) |
|
|
|
[Na+]
=
[HO
-]
=
|
|
|
| |
|
V |
|
| |
|
|
|
| |
|
0,010 |
|
| |
[Na+]
=
[HO
-]
=
|
|
|
| |
|
1,0 |
|
| |
|
|
|
| |
[Na+]
=
[HO
-]
≈
0,010
mol / L
|
-
-

-
-
-
3)- exercice 18 page 163.
-
L’addition
de quelques gouttes d’une solution de soude à une solution de sulfate de
cuivre II
provoque l’apparition d’un précipité d’hydroxyde de cuivre
II
Cu(OH)2.
-
a)-
Écrire l’équation chimique en supposant que les réactifs sont les
ions cuivre
II
Cu2+
et les ions hydroxyde
HO-.
| Cu
2+
(aq)
+
2
HO
–
(aq)
→
Cu
(OH)2
(s) |
-
-
b)-
la réaction chimique
est effectuée à partir de 20 mL d’une solution contenant 0,012 mol / L d’ions
Cu2+ .
-
-
Quelle est la quantité de matière d’ions cuivre
II
à l’état initial ?
-
-
Quantité de matière
d’ions cuivre
II
à l’état initial :
-
-
n
(Cu2 +)
=
C
. V
-
-
n
(Cu2 +)
=
0,12
×
20
×
10
- 3
-
-
n
(Cu2 +)
≈
2,4
×
10
- 3
mol
-
c)-
Établir un tableau d’avancement de la réaction chimique considérée
en supposant que l’on introduit
n
moles d’ions hydroxyde.
-
d)-
Quelle condition sur la valeur de
n
faut-il avoir pour que la soude soit en excès ?
-
-
En fin de réaction, si la soude est en excès, il reste des
ions hydroxyde
HO
-
et tous les ions cuivre
II
ont réagi :
-
2,4
× 10-3 –
x
= 0 et n – 2
x
> 0, en conséquence : n > 4,8
× 10-3 mol.
-
e)-
Si la solution de soude utilisée contient 2,0 mol / L d’ions
HO
-,
quel volume de solution de soude faut-il ajouter pour être dans les proportions
stœchiométriques ?
-
-
Proportions stœchiométriques : il faut que :
2,4
x
10-3 –
x
= 0 et n – 2
x
= 0,
-
-
On tire :
n
= 4,8
× 10-3 mol.
-
-
Volume de solution :
| |
n
=
C
.
V |
|
|
|
n |
|
|
|
V
=
|
|
|
| |
|
C |
|
| |
|
|
|
| |
|
2,4
×
10
- 3 |
| |
V
=
|
|
| |
|
2,0 |
| |
|
|
|
| |
V
≈
2,4
×
10 -
3
L
|
-
-

-
-
-
4)- Exercice 25 page 165.
-
Le
dihydrogène devient explosif, dans l’air, s’il est présent à plus de 4 %
en volume.
-
On
considère l’air comme un gaz parfait contenant, en volume 20 % de dioxygène
et un mélange de diazote.
-
a)-
Quelle équation chimique rend compte d’une telle réaction ?
-
-
Équation bilan de la réaction :
-
|
O2
(g) +
2 H2
(g)
→ 2
H2O
(ℓ)
|
b)-
Une fuite de dihydrogène conduit au remplacement de 4,0 % de l’air
d’un laboratoire de volume 120 m3, par du dihydrogène.
-
-
Quelle est la composition molaire de l’atmosphère du laboratoire ?
-
-
Volume de dihydrogène :
|
|
|
4,0 |
|
|
|
V
(H2)
=
|
|
× 120
|
| |
|
100 |
|
| |
|
|
|
| |
V
(H2)
≈
4,8 m
3
|
-
-
Volume de dioxygène :
|
|
|
20 |
|
|
|
V
(O2)
=
|
|
× (120 - 4,8)
|
| |
|
100 |
|
| |
|
|
|
| |
V
(O2)
≈
23 m
3
|
-
-
Volume de diazote :
|
|
|
80 |
|
|
|
V
(O2)
=
|
|
× (120 - 4,8)
|
| |
|
100 |
|
| |
|
|
|
| |
V
(O2)
≈
92 m
3
|
-
-
Composition molaire :
|
|
|
V
(H2) |
|
|
|
n
(H2)
=
|
|
|
| |
|
V
m |
|
| |
|
|
|
| |
|
4,8
× 10 3 |
|
| |
n
(H2)
=
|
|
|
| |
|
24 |
|
| |
|
|
|
| |
n
(H2)
≈
2,0
×
10 2
mol
|
-
-
-
Masse d’eau produite :
-
-
m
(H2O)
=
n
(H2O)
. M
(H2O)
-
-
m
(H2O)
=
2,0
× 10 2
×
18,0
-
-
m
(H2O)
≈
3,6 kg
-
d)-
Lors d’une telle explosion, la température de l’air augmente de 900
°C.
-
-
Estimer la pression dans le laboratoire et conclure.
-
-
On peut considérer que la quantité de matière lors de l’explosion
est pratiquement constante.
-
-
Le volume du laboratoire est constant lui aussi : d’après l’équation
d’état des gaz parfait, on tire que :
-
-
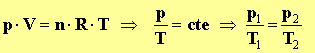
-
-
La température passe d’environ 300 K à 1200 K, elle a été multipliée
par 4, la pression
p
a été multipliée par quatre.
-
-
Les vitres et les portes du laboratoire sont soufflées, les personnes présentes
sont brûlées et fortement commotionnées.
-

-

-