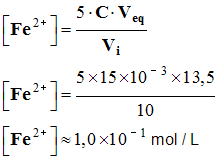|
TP Chimie. N° 10 |
Titrage colorimétrique. Correction |
|
|
|
|
|
- Que signifie titrer une espèce chimique en solution ?
- Titrer une espèce chimique en solution,
c’est déterminer sa concentration molaire dans la solution
- Qu’est-ce qu’un réactif de dosage ?
- C’est le réactif titré ou le réactif
à titrer.
- Qu’est-ce qu’un réactif de titrant ?
- Le réactif titrant est une espèce chimique
en solution de concentration connue qui réagit avec le réactif à titrer.
- Définir l’équivalence d’un titrage.
- à l’équivalence, les réactifs sont dans les proportions stœchiométriques définies par les coefficients de la réaction.
- à
l’équivalence,
il n’y a pas de réactif limitant.
- Quelles sont les caractéristiques d’une réaction de dosage ?
- La réaction de dosage doit être rapide,
totale, unique.
![]() Dans un tube à essais :
Dans un tube à essais :
- Introduire 2 mL de solution de sel de Mohr (1).
- Ajouter goutte à goutte une solution de permanganate de potassium
(K+ (aq) +
MnO4–
(aq))
acidifiée.
- Observer et interpréter sachant que
- les ions permanganate MnO4– donnent une couleur violette à la solution qui les contient
- que les ions fer II, Fe2+ (aq), donnent une couleur vert pâle à la solution qui les contient
- que les ions fer III, Fe3+ (aq), donnent une couleur jaune orangée à la solution qui les contient
- et que les autres ions sont incolores.
- Observations :
- La solution de permanganate de potassium (K+(aq) + MnO4– (aq)) acidifiée
- se décolore presque immédiatement en présence de sel de Mohr (ions fer II, Fe2+ (aq)).
- La solution dans le tube à essais prend
une teinte orange caractéristique des ions fer
III,
Fe3+ (aq).
![]() Citer les deux couples oxydant / réducteur mis en jeu. Établir
l’équation bilan de la réaction de titrage.
Citer les deux couples oxydant / réducteur mis en jeu. Établir
l’équation bilan de la réaction de titrage.
|
- Couples oxydant / réducteur : - Fe3+ / Fe2+ - MnO4– / Mn2+ - Demi-équations électroniques : - Fe3+
+
e
–
=
Fe2+
|
- Repérer le matériel fourni. Le schématiser et noter les modes d’utilisation.
- Noter les caractéristiques de toutes les solutions mises à votre disposition.
- La solution de permanganate de potassium est violette (les ions permanganate MnO4– donnent une couleur violette à la solution qui les contient).
- La solution de sel de Mohr (2) est vert pâle (les ions fer II, Fe2+ (aq), donnent une couleur vert pâle à la solution qui les contient)
- Les ions fer III, Fe3+ (aq), donnent une couleur jaune orangée à la solution qui les contient.
- et que les autres ions sont incolores.
- Remarque :
- La burette de Mohr recevra la solution de permanganate de potassium et un bécher recevra la solution de sel de Mohr.
- Rincer la burette avec la solution de permanganate de potassium de concentration C0 = 15 mmol / L.
- Remplir la burette avec la solution de permanganate de potassium (solution oxydante) et ajuster le niveau au zéro de la graduation.
- À l’aide d’une pipette munie de sa propipette, prélever un volume V = 10 mL de la solution de sel de Mohr (solution réductrice).
- Faire s’écouler le liquide le long de la paroi du bécher.
- Ajouter un barreau aimanté.
- Ajouter un peu d’eau distillée.
- Placer le bécher au-dessous de la burette de Mohr et sur un agitateur magnétique.
![]() Faire un schéma du dispositif prêt à fonctionner.
Faire un schéma du dispositif prêt à fonctionner.

![]() Verser mL par mL la solution de permanganate de potassium jusqu’à
l’obtention du changement de couleur observé lors de l’expérience préliminaire.
Verser mL par mL la solution de permanganate de potassium jusqu’à
l’obtention du changement de couleur observé lors de l’expérience préliminaire.
![]() Noter le volume,
V1
de solution de permanganate de potassium versé.
Noter le volume,
V1
de solution de permanganate de potassium versé.
- V1 = 14 mL
![]() Avec quelle précision connaît-on le volume versé à l’équivalence ?
Avec quelle précision connaît-on le volume versé à l’équivalence ?
- Précision de l’ordre du millilitre.
En conséquence : 13 mL <
Veq <
14
mL
![]() Recommencer le titrage, mais en versant d’un seul coup un volume
V1 – 2 mL de
réactif titrant.
Recommencer le titrage, mais en versant d’un seul coup un volume
V1 – 2 mL de
réactif titrant.
- Continuer ensuite goutte à goutte jusqu’au changement de couleur.
![]() Noter
Veq
le volume versé.
Noter
Veq
le volume versé.
- Veq
≈ 13,5 mL
![]() Avec quelle précision connaît-on le volume versé à l’équivalence ?
Avec quelle précision connaît-on le volume versé à l’équivalence ?
-
Le volume versé à l’équivalence est connu
à la goutte près (ordre de grandeur de 0,05 mL à 0,10 mL)
![]() Construire le tableau descriptif de l’évolution du système pour
un volume
V quelconque de solution
de permanganate de potassium versé.
Construire le tableau descriptif de l’évolution du système pour
un volume
V quelconque de solution
de permanganate de potassium versé.
- Tableau d’avancement de la réaction : pour un volume V < Veq.
|
Équation |
MnO4–
(aq) |
+
8
H+
(aq) |
+
5
Fe2+
(aq) |
→ |
Mn2+
(aq) |
+
5 Fe3+
(aq) |
+
4 H2O(ℓ) |
|
|
État |
Avanc. |
|
|
|
|
|
|
|
|
É.I
(mol) |
|
n1 = C.V |
excès |
n1 = [Fe2+].Vi |
0 |
0 |
solvant |
|
|
équi |
n1 = C.
Veq |
excès |
n1 = [Fe2+].Vi |
0 |
0 |
solvant |
||
|
Au
cours |
|
C.V
– x |
|
[Fe2+].Vi
–
5 x |
x |
5
x |
solvant |
|
|
É.F (mol) |
|
C.V
– xmax |
|
[Fe2+].Vi
– 5 xmax |
x
max |
5
xmax |
solvant |
|
|
équi |
C.Veq – xmax = 0 |
|
[Fe2+].Vi
–
5
xmax
= 0 |
|
x
max |
5
xmax |
solvant |
|
![]() Établir les relations concernant les quantités de matière qui
permettent de déterminer la concentration des ions fer II de la solution de sel
de Mohr.
Établir les relations concernant les quantités de matière qui
permettent de déterminer la concentration des ions fer II de la solution de sel
de Mohr.
- À l’équivalence, les réactifs sont dans les proportions stœchiométriques : il n’y a pas de réactifs limitant.
- Tous les réactifs ont été consommés.
- C.Veq – xmax = 0
=> xmax
= C.Veq
(1)
-
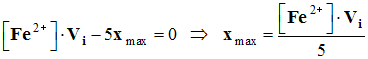 (2)
(2)
- En combinant (1) et (2) :
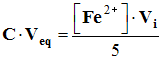
![]() Donner l’expression littérale de la concentration recherchée.
Donner l’expression littérale de la concentration recherchée.
- 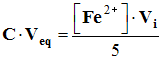 de cette expression, on tire :
de cette expression, on tire :
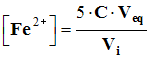
![]() Calculer la valeur de la concentration en ions fer
II de la solution
de sel de Mohr.
Calculer la valeur de la concentration en ions fer
II de la solution
de sel de Mohr.
- Concentration en ions fer II :
-