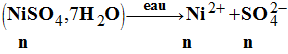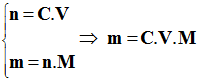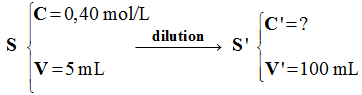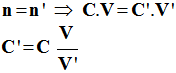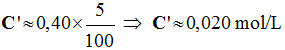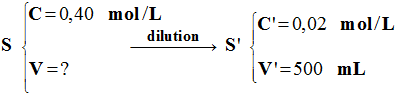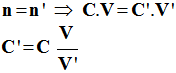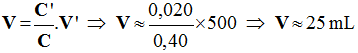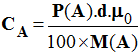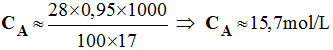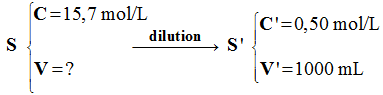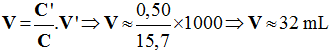|
Chimie N° 01 Solutions Aqueuses. Exercices |
|
|
|
|
Préparation d’une solution de sulfate de nickel. Le sulfate de nickel (II) heptahydraté
a pour formule NiSO4,
7 H2O. 1)- Quelle masse de ce solide
faut-il dissoudre pour préparer 500 mL de solution de
concentration 0,025 mol . L–1 ? 2)- Décrire soigneusement la
préparation de cette solution.
Correction exercice 12 1)- Masse de solide nécessaire. -
- Soit n la quantité de matière de soluté présent dans le volume V de solution de concentration C. -
-
M =
58,7 + 32 + 4
× 16
+ 7
× 18 -
M =
280,7 g -
m =
0,025
× 0,5
×
280,7
=>
m =
3,51 g 2)- Description |
|
Solution de sel de Mohr. Le sel de Mohr est un corps
cristallisé de formule FeSO4, (NH4)2SO4,
6 H2O. 1)- Quelle est sa masse molaire ? 2)- Donner le nom et la formule des ions obtenus lors de sa dissolution : en déduire
l’équation-bilan de cette dissolution. 3)- On dissout 0,784 g de sel de Mohr dans une fiole jaugée de 100 mL, que l’on complète jusqu'au trait de jauge avec de l’eau distillée. Déterminer
la valeur de la concentration de la solution et des ions
présents dans la solution obtenue. Correction
de l'exercice 13 : 1)- Masse molaire du sel de MOHR. -
M =
56 + 32 + 4
× 16 + 2
× 18 + 32 + 4
× 16 + 6
× 18 -
M =
392 g 2)- Nom et formule des ions présents
: -
La solution contient : -
Des ions fer II Fe2+, des ions ammonium
NH4+, et des ions sulfate SO42–. -
Équation bilan de la réaction de dissolution -
-
Concentration de la solution : - -
[Fe2+]
= = C = 2,00 x 10
–2 mol / L
-
[NH4+]
= [SO42–]
= 2
C -
Électroneutralité : 2 . [Fe2+]
+ [NH4+] = 2 .
[SO42–] |
|
Dilutions de solutions. On dispose d’une solution S de chlorure de sodium à 0,40 mol . L–1. 1)- Déterminer dans chaque cas
ci-après la concentration molaire de la solution fille
obtenue : a)-
5 mL de S diluée avec
de l’eau distillée dans une fiole jaugée de 100 mL. b)-
20 mL de S diluée avec
de l’eau distillée dans une fiole jaugée de 250 mL. 2)- Quel volume de S faut-il diluer
pour préparer 500 mL de solution de concentration 0,02 mol .
L–1.
Correction de l'exercice 14 1)- On dispose d'une solution mère S que l'on dilue pour obtenir une solution fille S'. ► Au cours de la dilution la quantité de matière de soluté se conserve a)- Premier cas :
- Relation de conservation : -
-
b)- Deuxième cas : idem C'' = 0.032 mol /L 2)- Volume de solution S.
- Relation de conservation : -
-
|
|
Utilisation d’une solution
commerciale. L’étiquette d’une solution commerciale d’ammoniac NH3 indique :
- d
= 0,95
- Pourcentage massique en
ammoniac : 28 % 1)- Déterminer la concentration
molaire de cette solution en ammoniac. 2)- En déduire le volume de cette
solution qu’il faut utiliser pour préparer un litre de
solution d’ammoniac à 0,50 mol . L–1. 3)- Décrire soigneusement cette
préparation.
Correction de l'exercice 17. 1)- Concentration de la solution commerciale. On donne d = 0,95 et P(NH3) = 28 % - - 2)- Volume de la solution commerciale - - Relation de conservation :
- 2)- Mode opératoire : |
|
Solution de permanganate de
potassium. À partir de permanganate de potassium
KMnO4 solide, on souhaite préparer 500 mL de solution de
concentration 0,010 mol . L–1. Décrire, de façon détaillée, la
préparation de cette solution. Correction de l'exercice 21 : - Masse molaire du permanganate de potassium
- M = 39,1 +
54,9 + 4 x 16
- M
= 158 g /
mol
- Concentration molaire :
C = 0,010 mol / L
- Volume de la solution :
V = 500 mL = 0,5 L - Masse de soluté - m = C.M.V - m = 0,01 × 158 × 0,5 - m = 0,79 g |
|
|
|
|