|
TP Chimie N° 07 |
Dosage d'un déboucheur et d'un détartrant : correction. |
|
|
|
|
Programme 2012 : Physique et Chimie Programme 2020 : Physique et Chimie |
|
Matériel : Béchers, burette graduée de 25 mL, pipettes jaugées de 5 mL et 10 mL, propipette, fioles jaugées de 100 mL et de 250 mL, gants et lunettes. Balance de précision, agitateur magnétique. Produit détartrant WC NET et liquide déboucheur Destop, solution d’acide chlorhydrique de concentration CA = 0,10 mol / L et de la soude de concentration CB = 0,10 mol / L et des indicateurs colorés. |
|
II - Dosage d'un produit domestique détartrant (WC Net) par la soude . III - Dosage d'un produit domestique déboucheur (DESTOP) par l'acide chlorhydrique . |
|
Doser un produit domestique contenant de la soude (déboucheur) et doser un produit domestique contenant de l’acide chlorhydrique (détartrant). On réalise, à partir d’un échantillon du produit à doser, une solution diluée que l’on dose en présence d’un indicateur coloré adapté. Le dosage de l’acide contenu dans la solution de détartrant s’effectue avec la solution titrée de soude et le dosage de la base contenue dans le liquide déboucheur s’effectue avec la solution titrée d’acide chlorhydrique. |
II- Dosage d’un produit domestique détartrant (WC
NET) par la soude (rangée 1).![]()
1)- Étude préliminaire.
- Relever les indications portées sur la bouteille et lire les consignes de sécurité.
- Acide chlorhydrique à 13,5 % - Produit corrosif
- Proposer une expérience permettant de déterminer la densité d de la solution commerciale utilisée.
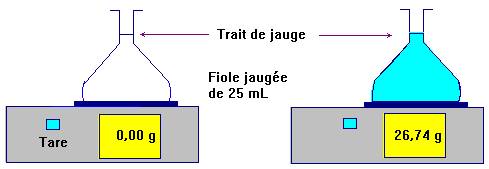
- Détermination de la densité :
- Le fabriquant donne le pourcentage massique. Le relever.
-
Pourcentage massique : 13,5 % Cela signifie que 100 g de solution
commerciale contiennent 13,5 g de
HCl pur.
- La détermination de la densité d de la solution est réalisée par un groupe (lunettes et gants).
- Donner la valeur de la densité d de la solution et en déduire la concentration C de la solution commerciale.
-
Valeur de la densité : la masse volumique de l’eau est
ρ0 =
1,00 g / mL
-
La masse
m de 25 mL d’eau est :
m = 25,0 g
|
|
|
=> |
d ≈ 1,07 |
- Sachant que :
|
=> |
|
=> |
ρ' ≈ 1,07 g / cm 3 |
- Valeur de la concentration de la solution commerciale :
- Masse de 1 L de solution commerciale :
|
- Masse de HCl présente dans 1 L de solution :
|
. m' |
|
- Quantité de matière de HCl présente dans 1 L de solution :
|
|
- Concentration de la solution en soluté HCl :
|
|
-
Attention aux unités :
|
Concentration
C |
Pourcentage Massique P |
Densité d |
Masse Molaire
M |
Masse Volumique de l’eau ρ0 |
|
mol / L |
Pas d’unité |
Pas d’unité |
g / mol |
ρ0 = 1000 g / L |
-
Programme à la calculatrice :
-
Input ‘’densité
d = ‘’,
d
-
Input ‘’Pourcentage massique
P = ‘’,
p
-
Input ‘’Masse molaire
M = ‘’,
M
-
Disp ’’Concentration C mol / L = ‘’, 10 *
p *
d /
M
-
Concentration de la solution commerciale à partir de la valeur de la
densité et du pourcentage massique :
|
|
|
||||||||||||||||
2)- Préparation de la solution à doser.
- La solution commerciale est trop concentrée.
- Pour la manipuler en toute sécurité, on va la diluer. On dilue 50 fois la solution commerciale S, on obtient la solution S1.
- On veut préparer 250 mL de solution S1. Décrire brièvement le mode opératoire en précisant le matériel utilisé.
- Un groupe réalise la dilution, puis chaque groupe prend environ 20 mL de la solution S1 dans un bécher.
-
Préparation de la solution à doser :
|
S |
{ |
C = |
Dilution |
S 1 |
{ |
C1 = C / 50 |
|
V = 5,0 mL |
→ |
V1 = 250 mL |
||||
|
n = C . V |
|
n1 = C1 . V1 |
||||
|
Solution mère |
|
Solution fille |
||||
-
Au cours de la dilution, il y a conservation de la quantité de matière
de soluté :
- n = C . V = n1 = C1 . V1
3)- Réaction de dosage.
![]() Remplir la burette graduée de soude de concentration
CB = 0,10 mol / L jusqu’au zéro de la
graduation.
Remplir la burette graduée de soude de concentration
CB = 0,10 mol / L jusqu’au zéro de la
graduation.
- Prélever un volume V1 = 10,0 mL de solution S1 et les verser dans un bécher.
- Ajouter environ 10 mL d’eau distillée et quelques gouttes de B.B.T.
- Placer le barreau aimanté et maintenir une agitation douce.
- Ajouter la soude jusqu’au virage du B.B.T. et relever le volume de soude versé VBE =.
-
Volume de base versée à l’équivalence :
VBE
≈
7,9 mL
4)- Exploitation.
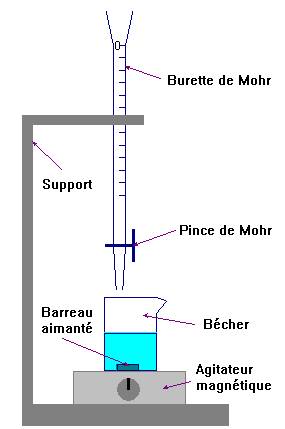
![]() Faire un schéma du dispositif.
Faire un schéma du dispositif.
-
Schéma du dispositif :
![]() Écrire l’équation de la réaction de dosage.
Écrire l’équation de la réaction de dosage.
-
Formule de l’acide chlorhydrique : (H3O+(aq) + Cl
-
(aq)
)
- Formule de la soude : (Na+ (aq) + HO – (aq))
-
Réaction de dosage :
H3O+(aq) + HO – (aq) = 2 H2O (ℓ)
![]() Donner la définition générale de l’équivalence.
Donner la définition générale de l’équivalence.
-
Il y a équivalence lorsque les réactifs ont été mélangés dans les proportions
stœchiométriques définies par les coefficients de la réaction.
-
À l’équivalence, la quantité de matière d’ions hydroxyde ajoutée est
égale à la quantité de matière d’ions oxonium initialement présente.
![]() Quel est le rôle du B.B.T ? Pourquoi l’a-t-on choisi ?
Donner la relation de dosage.
Quel est le rôle du B.B.T ? Pourquoi l’a-t-on choisi ?
Donner la relation de dosage.
En déduire la concentration C1 de la solution S1 puis la concentration C de la solution commerciale.
-
Rôle du B.B.T : c’est un indicateur coloré acido-basique qui
permet de repérer l’équivalence.
- À l’équivalence, le pHE = 7,0.
-
Le
pH du point équivalent
appartient à la zone de virage [ 6,0 ; 7,6
] de l’indicateur coloré.
-
Relation de dosage :
-
À l’équivalence, la quantité de matière d’ions hydroxyde ajoutée est
égale à la quantité de matière d’ions oxonium initialement présente.
- n (H3O+ ) = n (HO – ) => C1 . V1 = CB . VBE
-
Concentration de la solution
S1 :
|
=> |
|
||||||||
|
C1 ≈ 7,9 × 10 - 2 mol / L |
||||||||||
-
Concentration de la solution mère
S
(solution commerciale) à partir du dosage :
- C = 50 C1 => C ≈ 50 × 7,9 x 10 - 2 => C ≈ 3,95 mol / L
![]() Déterminer la valeur du pourcentage massique de la solution
commerciale.
Déterminer la valeur du pourcentage massique de la solution
commerciale.
- Comparer le résultat obtenu à celui indiqué par le fabriquant. Conclusion.
-
Pourcentage massique :
|
|
|
||||||||||||||||||||||||||||
- Incertitude relative :
|
ΔP |
|
| 13,50 - 13,47 | |
|
|
≈ |
|
|
P |
|
13,50 |
|
ΔP |
|
|
|
|
≈ 0,22 % |
|
|
P |
|
|
III- Dosage d’un produit domestique déboucheur(destop) par l’acide chlorhydrique (rangée
2).![]()
1)- Étude préliminaire.
- Relever les indications portées sur la bouteille et lire les consignes de sécurité.
- Proposer une expérience permettant de déterminer la densité d de la solution commerciale utilisée.

- Le fabriquant donne le pourcentage massique. Le relever.
-
Soude caustique : solution à 20 %. Cela signifie que 100 g de
solution commerciale contiennent 20,0 g de
NaOH
pur.
- La détermination de la densité d de la solution est réalisée par un groupe (lunettes et gants).
- Donner la valeur de la densité d de la solution et en déduire la concentration C de la solution commerciale.
-
La masse
m de 25 mL d’eau est :
m = 25,0 g
|
=> |
|
=> |
d ≈ 1,216 |
- Sachant que :
|
|
|
=> |
ρ' ≈ 1,216 g / cm 3 |
- Valeur de la concentration de la solution commerciale :
- Masse de 1 L de solution commerciale :
|
- Masse de NaOH présente dans 1 L de solution :
|
. m' |
|
- Quantité de matière de NaOH présente dans 1 L de solution :
|
|
- Concentration de la solution en soluté NaOH :
|
|
-
Attention aux unités :
|
Concentration
C |
Pourcentage Massique P |
Densité d |
Masse Molaire
M |
Masse Volumique de l’eau ρ 0 |
|
mol / L |
Pas d’unité |
Pas d’unité |
g / mol |
ρ 0 = 1000 g / L |
-
Programme à la calculatrice :
-
Input ‘’densité d = ‘’, d
-
Input ‘’Pourcentage massique P = ‘’, p
-
Input ‘’Masse molaire M = ‘’,M
-
Disp ’’Concentration C mol / L = ‘’, 10 * p * d / M
-
Concentration de la solution commerciale à partir de la valeur de la
densité et du pourcentage massique :
|
|
|
||||||||||||||||
2)- Préparation de la solution à doser.
- La solution commerciale est trop concentrée. Pour la manipuler en toute sécurité, on va la diluer.
- On dilue 50 fois la solution commerciale S, on obtient la solution S2.
- On veut préparer 250 mL de solution S2. Décrire brièvement le mode opératoire en précisant le matériel utilisé.
- Un groupe réalise la dilution, puis chaque groupe prend environ 20 mL de la solution S 2 dans un bécher.
-
Préparation de la solution à doser :
|
S |
{ |
C = |
Dilution |
S 1 |
{ |
C 1 = C / 50 |
|
V = 5,0 mL |
→ |
V 1 = 250 mL |
||||
|
n = C . V |
|
n 1 = C 1 . V 1 |
||||
|
Solution mère |
|
Solution fille |
||||
-
Au cours de la dilution, il y a conservation de la quantité de matière
de soluté :
- n = C . V = n1 = C1 . V1
3)- Réaction de dosage.
I Remplir la burette graduée d’acide chlorhydrique de concentration CA = 0,10 mol / L jusqu’au zéro de la graduation.
- Prélever un volume V2 = 10,0 mL de solution S2 et les verser dans un bécher.
- Ajouter environ 10 mL d’eau distillée et quelques gouttes de B.B.T.
- Placer le barreau aimanté et maintenir une agitation douce.
- Ajouter l’acide chlorhydrique jusqu’au virage du B.B.T. et relever le volume d’acide versé VAE =.
-
Volume d’acide versé à l’équivalence :
VAE
≈ 12,5 mL
4)- Exploitation.
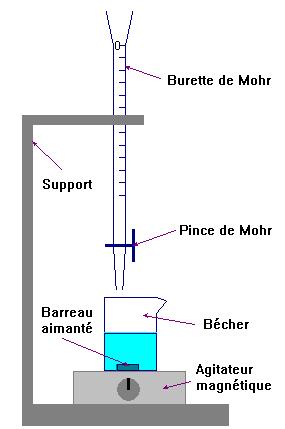
![]() Faire un schéma du dispositif.
Faire un schéma du dispositif.
![]() Écrire l’équation de la réaction de dosage.
Écrire l’équation de la réaction de dosage.
-
Formule de l’acide chlorhydrique : (H3O+(aq)
+ Cl
-
(aq)
)
- Formule de la soude : (Na+ (aq) + HO – (aq))
-
Réaction de dosage :
H3O+(aq) + HO – (aq) = 2 H2O (ℓ)
![]() Donner la définition générale de l’équivalence.
Donner la définition générale de l’équivalence.
-
Il y a équivalence lorsque les réactifs ont été mélangés dans les proportions
stœchiométriques définies par les coefficients de la réaction.
-
À l’équivalence, la quantité de matière d’ions oxonium ajoutée est égale
à la quantité de matière d’ions hydroxyde initialement présente.
![]() Quel est le rôle du B.B.T ? Pourquoi l’a-t-on choisi ?
Donner la relation de dosage.
Quel est le rôle du B.B.T ? Pourquoi l’a-t-on choisi ?
Donner la relation de dosage.
![]() En déduire la concentration
C2
de la solution
S2
puis la concentration
C de la solution
commerciale.
En déduire la concentration
C2
de la solution
S2
puis la concentration
C de la solution
commerciale.
-
Rôle du B.B.T : c’est un indicateur coloré acido-basique qui
permet de repérer l’équivalence.
- À l’équivalence, le pHE = 7,0.
-
Le
pH du point équivalent
appartient à la zone de virage [ 6,0 ; 7,6
] de l’indicateur coloré.
-
Relation de dosage :
-
À l’équivalence, la quantité de matière d’ions oxonium ajoutée est égale
à la quantité de matière d’ions hydroxyde initialement présente.
- n (HO –) = n (H3O+) => C1 . V1 = CA . VAE
-
Concentration de la solution
S1 :
|
=> |
|
||||||||
|
C1 ≈ 1,25 × 10 - 1 mol / L |
||||||||||
-
Concentration de la solution mère
S
(solution commerciale) à partir du dosage :
- C = 50 C1 => C ≈ 50 × 1,25 × 10 - 1 => C ≈ 6,25 mol / L
![]() Déterminer la valeur du pourcentage massique de la solution
commerciale.
Déterminer la valeur du pourcentage massique de la solution
commerciale.
![]() Comparer le résultat obtenu à celui indiqué par le fabriquant.
Comparer le résultat obtenu à celui indiqué par le fabriquant.
![]() Conclusion.
Conclusion.
-
Pourcentage massique :
|
|
|
|||||||||||||||||||||||||||||||
- Incertitude relative :
|
|
≈ |
3,0 % |