|
TP Chimie N°05 |
Étude
spectrophotométrique d'un
indicateur coloré. |
|
|
|
|
Programme 2012 : Physique et Chimie Programme 2020 : Physique et Chimie |
|
BUT :
Déterminer par spectrophotométrie les domaines de prédominance des formes acide et basique du B.B.T. Déterminer la constante d’équilibre de la réaction de cet indicateur coloré avec l’eau. |
|
Matériel : |
|
- Les indicateurs colorés donnent lieu à des transformations non totales en solution aqueuse.
- Le B.B.T existe sous deux formes :
- Sa forme acide de teinte jaune que l’on note HInd.
- Sa forme basique de teinte bleue que l’on note Ind – .
- On mesure, à la même longueur d’onde,
- en milieu très acide, l’absorbance Aa de la forme jaune,
- en milieu très basique, l’absorbance Ab de la forme bleue
- et à un pH intermédiaire, l’absorbance Am d’un mélange des deux formes.
- On déduit de ces mesures la valeur du pKA du B.B.T.
1)- Préparation des solutions.
a)- Préparation de la solution mère S à 0,5 g / L.
![]() Peser 0,10 g de
B.B.T. Introduire cette masse dans une fiole jaugée
de 200 mL.
Peser 0,10 g de
B.B.T. Introduire cette masse dans une fiole jaugée
de 200 mL.
- Ajouter 5 mL d’eau distillée et compléter avec de l’alcool à 90 ° jusqu’au trait de jauge.
b)- Préparation des solutions filles.
|
Solution acide |
Sa |
Verser 2,5 mL de la solution mère S dans une fiole jaugée de 50 mL. Compléter avec une solution d’acide chlorhydrique de concentration C1= 0,10 mol / L. |
|
Solution ‘’neutre’’ (mélange) |
Sm |
Verser 2,5 mL de la solution mère S dans une fiole jaugée de 50 mL. Compléter avec une solution tampon de pH = 7 jusqu’au trait de jauge |
|
Solution basique |
Sb |
Verser 2,5 mL de la solution mère S dans une fiole jaugée de 50 mL. Compléter avec une solution de soude de concentration C2= 0,10 mol / L. |
- On note C la concentration en B.B.T de chacune des solutions.
2)- Mesure du pH.
![]() Avec un
pH-mètre étalonné, mesurer le
pH
de chacune des solutions filles préparées puis compléter le tableau.
Avec un
pH-mètre étalonné, mesurer le
pH
de chacune des solutions filles préparées puis compléter le tableau.
|
Solution |
Sa |
Sm |
Sb |
|
pH |
pHa = |
pHm = |
pHb = |
3)- Mesure des spectres d’absorption.
- Pour chacune des trois solutions filles, on trace le spectre d’absorption A = f (λ).
- Il faut faire le blanc entre chaque mesure car on change la longueur d’onde λ de la radiation lumineuse.
- Pour la solution Sa, on fait le blanc avec une solution d’acide chlorhydrique (C1 = 0,10 mol / L),
- pour la solution Sm, on utilise la solution tampon de pH = 7
et pour la solution Sb, on utilise la solution de soude (C2 = 0,10 mol / L).
- Compléter le tableau :
|
λ nm |
340 |
360 |
380 |
400 |
420 |
440 |
460 |
480 |
500 |
520 |
|
Am |
|
|
|
|
|
|
|
|
|
|
|
Aa |
0,393 |
0,394 |
0,466 |
0,649 |
0,795 |
0,834 |
0,729 |
0,533 |
0,333 |
0,189 |
|
Ab |
0,201 |
0,254 |
0,336 |
0,380 |
0,257 |
0,114 |
0,089 |
0,141 |
0,245 |
0,391 |
|
λ nm |
540 |
560 |
580 |
600 |
620 |
640 |
660 |
680 |
700 |
|
Am |
|
|
|
|
|
|
|
|
|
|
Aa |
0,102 |
0,060 |
0,043 |
0,034 |
0,032 |
0,030 |
0,030 |
0,030 |
0,030 |
|
Ab |
0,591 |
0,861 |
1,167 |
1,473 |
1,638 |
1,314 |
0,635 |
0,203 |
0,050 |
III- Exploitation des résultats.
1)- Écrire l’équation simplifiée de la réaction entre le B.B.T et l’eau.
2)- donner l’expression de la constante d’équilibre KA de cette réaction.
Puis donner l’expression du pH de la solution en fonction du pKA et des concentrations en acide et base conjuguée.
3)- Quelles sont les formes qui prédominent dans chaque solution ?
4)- Exprimer les concentrations de HInd et Ind – en fonction de C dans chaque solution.
|
Solution |
Sa |
Sm |
Sb |
|
Expression |
|
|
|
5)- Pourquoi le B.B.T change-t-il de couleur en fonction du pH ?
6)- Tracer sur un même graphe Am = f (λ) ; Aa = f (λ) ; Ab = f (λ) .
Déterminer les valeurs des longueurs d’onde λ1 et λ2 correspondant aux maxima d’absorption des espèces HInd et Ind –.
7)- On note les absorbances respectives : Aa , Am, Ab .
Appliquer la loi de Beer-Lambert à chacune des trois solutions pour la longueur d’onde λ1.
8)- Exprimer les absorbances en fonction de la concentration C. En déduire les expressions de εa et εb.
9)- Donner l’expression de Am en fonction de Ab et Aa.
10)- exprimer Am en fonction de C et [HInd]m.
11)-
En déduire la relation suivante :
![]() .
.
12)- Pour la longueur d’onde λ2, on note les absorbances respectives : A'a , A'm, A'b.
reprendre le même raisonnement à partir de la question 7)-.
En déduire la relation :
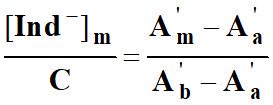 .
.
13)-
Donner l’expression du rapport
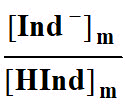 dans la solution
Sm.
dans la solution
Sm.
14)- Déterminer la valeur expérimentale de pKA du B.B.T.