|
TP Chimie. N° 03 |
Avancement finalde réactions acido-basiques : Correction. |
|
|
|
|
Programme 2012 : Physique et Chimie Programme 2020 : Physique et Chimie |
|
Matériel
: |
Acide éthanoïque pur, fiole jaugée de 500 mL (1), eau distillée, pH-mètre, solutions tampons, pipette graduée de 5 mL, solutions : acide chlorhydrique : C = 1,0 × 10–1 mol / L, C1 = 1,0 × 10–2 mol / L,
éthanoate de sodium (solide)
et chlorure de sodium (solide)
Pipette jaugée de 10 mL et fiole jaugée de 100 mL, pH-mètre, agitateur magnétique, barreau aimanté, |
|
Données :
|
masse molaire de l’acide éthanoïque M = 60,05 g / mol densité : d = 1,05 ; masse volumique de l’eau :
μ
0 = 1,00 g / cm3. |
|
But : Mesurer le pH de solutions acides de concentrations différentes. Étudier le taux d’avancement de la réaction entre un acide et l’eau. |
1)- Présentation de l’appareil.



2)- étalonnage.
Étalonnage du pH- mètre
![]() Sortir
la sonde de l'eau distillée et l'essuyer délicatement avec du papier Joseph.
Sortir
la sonde de l'eau distillée et l'essuyer délicatement avec du papier Joseph.
![]() Plonger
la sonde dans la solution tampon de pH =
7,00.
Plonger
la sonde dans la solution tampon de pH =
7,00.

![]() Régler
le bouton d’étalonnage (OFFSET), à l’aide du tournevis, pour que le pH-mètre
affiche la valeur 7,00.
Régler
le bouton d’étalonnage (OFFSET), à l’aide du tournevis, pour que le pH-mètre
affiche la valeur 7,00.
![]() Sortir
la sonde de la solution tampon, la rincer avec de l'eau distillée et l'essuyer
délicatement avec du papier Joseph.
Sortir
la sonde de la solution tampon, la rincer avec de l'eau distillée et l'essuyer
délicatement avec du papier Joseph.
![]() Plonger
la sonde dans une solution tampon de pH = 4,00.
Plonger
la sonde dans une solution tampon de pH = 4,00.

![]() Régler
le bouton d'étalonnage (SLOPE) pour que le pH-mètre affiche 4,00.
Régler
le bouton d'étalonnage (SLOPE) pour que le pH-mètre affiche 4,00.
![]() Sortir
la sonde de la solution tampon, la rincer avec de l'eau distillée et l'essuyer
délicatement avec du papier Joseph.
Sortir
la sonde de la solution tampon, la rincer avec de l'eau distillée et l'essuyer
délicatement avec du papier Joseph.
![]() Plonger
la sonde dans l'eau distillée en attendant de faire les mesures.
Plonger
la sonde dans l'eau distillée en attendant de faire les mesures.
![]() Sortir
la sonde de l'eau distillée.
Sortir
la sonde de l'eau distillée.
![]() La
rincer (avec de l'eau distillée, ou mieux, avec la solution dont on veut mesurer
le pH) et l'essuyer délicatement.
La
rincer (avec de l'eau distillée, ou mieux, avec la solution dont on veut mesurer
le pH) et l'essuyer délicatement.
![]() Plonger
la sonde dans la solution dont on veut mesurer le pH. Attendre la stabilité
(quelques secondes). Lire la valeur du pH.
Plonger
la sonde dans la solution dont on veut mesurer le pH. Attendre la stabilité
(quelques secondes). Lire la valeur du pH.
![]() Sortir
la sonde de la solution, la rincer et la plonger dans l'eau distillée en attendant
la prochaine mesure.
Sortir
la sonde de la solution, la rincer et la plonger dans l'eau distillée en attendant
la prochaine mesure.
Le pH-mètre est étalonné. Il ne faut plus changer les réglages.
II-
étude
de la réaction entre l’acide éthanoïque et l’eau.![]()
1)- Mise en solution aqueuse de l’acide éthanoïque.
a)- expérience 1 : L’expérience est réalisée par un binôme.
Préparation de la solution mère S.
![]() Mode opératoire :
Mode opératoire :
- Mettre les gants et les lunettes.
- Prendre une fiole jaugée de 500 mL.
- La remplir partiellement d’eau distillée.
- verser avec précaution :
- ma = 3,00 g que l'on pèse avec une balance électronique d’acide éthanoïque pur.
- Compléter avec de l’eau distillée (3 / 4),
- Homogénéiser, puis compléter jusqu’au trait de jauge et mélanger.
- Remarque : chaque groupe prend 50 mL de la solution S.
b)- Expérience 2 :
Préparation de la solution fille S1.
![]() Indiquer
le matériel nécessaire à la préparation de 100 mL de la solution fille
S1.
Indiquer
le matériel nécessaire à la préparation de 100 mL de la solution fille
S1.
- La solution fille est obtenue en diluant 10 fois la solution mère S.
- Matériel nécessaire : pipette jaugée (10 mL) munie de sa propipette et fiole jaugée (100 mL), bécher, solution S et eau distillée.
![]() Préparer la solution fille
S1.
Préparer la solution fille
S1.
c)- Mesures : mesurer le pH de la solution mère S et de la solution fille S1.
2)- Exploitation.
![]() Déterminer
la valeur de la quantité de matière
napp en soluté apporté lors de la préparation de la solution
mère.
Déterminer
la valeur de la quantité de matière
napp en soluté apporté lors de la préparation de la solution
mère.
- En déduire les valeurs des concentrations C de la solution mère et C1 de la solution fille.
- Quantité de matière en soluté apporté.
- 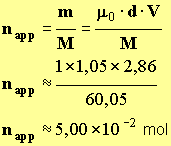
- Concentration de la solution d’acide éthanoïque en soluté apporté
- 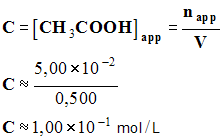
- Concentration de la solution fille.
-
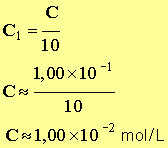
- Présenter les résultats sous forme de tableau :
|
|
Concentration
mol / L |
pH |
|
Solution
mère S |
1,00
× 10
–1 |
≈
2,9 |
|
Solution
fille S1 |
1,00
× 10
–2 |
≈
3,4 |
![]() Remarque
et conclusion.
Remarque
et conclusion.
- Lorsqu’on dilue un acide, le pH de la solution obtenue augmente.
-
Si, on poursuit la dilution de l’acide, le
pH
de la solution obtenue tend vers 7.
3)- Interprétation.
- Couple acide éthanoïque /
ion éthanoate : CH3COOH
(aq) / CH3COO
– (aq)
- Lors de la réaction
acido-basique,
- il
y a un transfert de proton de l’acide du couple,
CH3COOH
(aq) / CH3COO
– (aq
- vers
la base du couple H3O
+(aq)
/ H2O
(ℓ).
- Équation de la réaction :
pour le moment, on utilise la notation suivante :
![]() Dresser
le tableau d’avancement de la réaction.
Dresser
le tableau d’avancement de la réaction.
|
Équation |
AH (aq) + |
H2O (ℓ) |
→ |
A– (aq) |
+ H3O+(aq) |
|
|
état |
Avancement
x (mol) |
|
|
|
|
|
|
État
initial (mol) |
0 |
napp |
excès |
|
0 |
0 |
|
Au
cours de la
transformation |
x |
napp - x |
excès |
x |
x |
|
|
Avancement
final |
xf |
napp
– xf |
excès |
xf |
xf
|
|
|
Avancement
maximal |
xmax |
napp
- xmax
= 0 |
excès |
|
xmax |
xmax |
a)- Étude de la solution mère S.
- A partir de l’expérience 1, déterminer la valeur de l’avancement maximal xmax de la réaction.
- Remarque : le soluté apporté est l’acide éthanoïque pur.
- L’eau constituant majoritaire est le solvant.
- En conséquence, l’eau est en large excès.
- Le soluté est le réactif limitant de la réaction.
- Avancement maximal de la réaction entre l’acide éthanoïque et l’eau (expérience1)
- Le soluté est le réactif limitant de la réaction.
- L'eau est en large excès.
- napp = xmax ≈ 5,00 × 10 – 2 mol
- A partir de la valeur du pH de la solution mère, déterminer la valeur de l’avancement final xf de la réaction.
- Avancement final de ta réaction.
- On utilise la définition du
pH pour une solution diluée :
- [H3O+]f = 10 – pH mol / L
- [H3O+]f = 10– 2,9 mol / L
- [H3O+]f ≈ 1,3 × 10– 2 mol / L
- Quantité de matière d’ions oxonium
- xf = nf (H3O+) = [H3O+]f . V = 10 – pH . V
- xf = 10 – 2,9 × 0,500
- xf ≈ 6,3 × 10 – 4 mol
- D’après le tableau d’avancement de la réaction :
- xf = nf (H3O+) ≈ 6,3 × 10 – 4 mol
- Comparer les valeurs de xmax et xf.
- Conclusion :
- Que peut-on dire de la transformation chimique se produisant entre l’acide éthanoïque pur et l’eau ?
- Comparaison :
- napp = xmax ≈ 5,00 × 10 – 2 mol et xf ≈ 6,3 × 10 – 4 mol
- xf < xmax
- La réaction entre l’acide éthanoïque et l’eau n’est pas totale.
b)- Étude de la solution fille S1. Idem.
III- Étude de la réaction entre le chlorure
d’hydrogène et l’eau.![]()
1)- Mise en solution aqueuse du chlorure d’hydrogène.
- On dissout du chlorure d’hydrogène gazeux dans l’eau.
- On obtient une solution aqueuse appelée acide chlorhydrique.
- Les solutions sont déjà préparées.
- Solution mère S : C = 1,0 × 10 –1 mol / L.
- Solution fille S1 : C1 = 1,0 × 10 –2 mol / L.
2)- Mesures : mesurer le pH de la solution mère S et de la solution fille S1.
3)- Interprétation :
- Présenter les résultats sous forme de tableau :
|
|
Concentration mol / L |
pH |
|
Solution mère S |
1,00
× 10–1 |
≈
1,1 |
|
Solution fille S1 |
1,00
× 10–2 |
≈
2,0 |
- Quel renseignement peut-on tirer de la connaissance des concentrations ?
- Les indications sur les concentrations donnent les concentrations en soluté apporté.
- Elles
nous renseignent sur les quantités de matière, en soluté apporté, présentes
dans un volume donné de solution.
![]() Écrire
l ‘équation de la réaction entre le chlorure d’hydrogène (gaz) et l’eau.
Écrire
l ‘équation de la réaction entre le chlorure d’hydrogène (gaz) et l’eau.
HCl (g) + H2O (ℓ) → Cl – (aq) + H3O+(aq)
a)- Étude de la solution fille S1.
- déterminer la valeur de l’avancement maximal xmax de la réaction.
- Remarque : L’eau constituant majoritaire est le solvant.
- En conséquence, l’eau est en large excès.
- Le soluté est le réactif limitant de la réaction.
- Pour simplifier les calculs, on travaille avec
V = 1,00 L de solution.
|
Équation |
HCl (g) + |
H2O (ℓ) |
→ |
Cl – (aq) |
+ H3O+(aq) |
|
|
état |
Avancement
x (mol) |
|
|
|
|
|
|
État
initial (mol) |
0 |
napp |
excès |
|
|
0 |
|
Au
cours de la
transformation |
x |
napp - x |
excès |
x |
x |
|
|
Avancement
final |
xf |
napp
– xf |
excès |
xf |
xf |
|
|
Avancement
maximal |
xmax |
napp
- xmax
= 0 |
excès |
|
xmax |
xmax |
- napp
- napp
- napp
- Avancement maximal :
-
D’après le tableau d’avancement de la réaction,
on tire :
- napp = xmax ≈ 1,00 × 10– 2 mol
- A partir de la valeur du pH de la solution mère, déterminer la valeur de l’avancement final xf de la réaction.
- Avancement final de la réaction.
- La mesure du pH de la solution fille donne :
-
pH
≈ 2,0.
- Par définition :
- [H3O+]f = 10– pH mol / L
- [H3O+]f ≈ 10– 2,0 mol / L
- [H3O+]f ≈ 1,0 × 10– 2 mol / L
- D’après le tableau d’avancement de la réaction :
- xf = nf (H3O+) = [H3O+]f . V
- xf = 1,0 × 10– 2 × 1,0
- xf ≈ 1,0 × 10– 2 mol
- Comparer les valeurs de xmax et xf.
- Conclusion :
- Que peut-on dire de la transformation chimique se produisant entre le chlorure d’hydrogène et l’eau ?
- napp (HCl) = xmax ≈ 1,0 × 10 – 2 mol et xf ≈ 1,0 × 10 – 2 mol
- napp (HCl) = xmax = xf
- La réaction du chlorure d’hydrogène sur l’eau est totale.
b)- Étude de la solution S.
- Remarque
: pour la solution S,
C
= 1,0
× 10 –1 mol / L, et
pH
≈
1,1
- La solution d'acide chlorhydrique est trop concentrée et on ne peut pas utiliser la relation :
- pH = – log [H3O+]
IV- Étude complémentaire :
une
transformation chimique peut-elle avoir lieu dans les deux sens ?![]()
1)- Réaction entre les ions chlorure et les ions oxonium.
a)- Expérience 3 :
![]() Mode opératoire : verser 40 mL de solution
S
d’acide chlorhydrique dans un erlenmeyer.
Mode opératoire : verser 40 mL de solution
S
d’acide chlorhydrique dans un erlenmeyer.
- Placer la sonde pH-métrique, le barreau aimanté et maintenir l’agitation.
- Attendre que la valeur du pH se stabilise.
- Noter sa valeur et ajouter délicatement quelques grains de chlorure de sodium.
b)- Observations et interprétation.
- Lorsqu’on ajoute du chlorure de sodium (solide) dans une solution d’acide chlorhydrique, le pH de la solution ne varie pratiquement pas.
- On peut considérer que le volume de la solution n’a pas varié si l’on rajoute peu de chlorure de sodium solide.
- La réaction entre les ions chlorure et les ions oxonium ne s’effectue
pas.
2)- Réaction entre les ions éthanoate et les ions oxonium.
a)- Expérience 4 :
![]() Mode opératoire :
Mode opératoire :
- Verser 40 mL de solution S d’acide éthanoïque dans un erlenmeyer.
- Placer la sonde pH-métrique, le barreau aimanté et maintenir l’agitation.
- Attendre que la valeur du pH se stabilise.
- Noter sa valeur et ajouter délicatement quelques grains d’éthanoate de sodium.
b)- Observations et interprétation.
- Lorsqu’on ajoute quelques grains d’éthanoate de sodium dans une solution d’acide éthanoïque, le pH de la solution augmente.
- La concentration en ions oxonium diminue car on peut considérer que le volume de la solution ne varie pas.
- Il découle de ceci que la quantité de matière en ions oxonium diminue.
- Les ions oxonium réagissent avec les ions éthanoate.
- Il se produit une réaction acido-basique entre les ions éthanoate et les ions oxonium.
CH3COO – (aq) + H3O+ (aq) → CH3COOH (aq) + H2O (ℓ) (2)
CH3COOH (aq) + H2O (ℓ) → CH3COO – (aq) + H3O+ (aq) (1)
- Les réactions (1) et (2) sont inverses l’une de l’autre et se produisent simultanément.
- Elles annulent leurs effets.
- On est en présente d’un équilibre chimique dynamique.
- On écrit :
CH3COOH
(aq) +
H2O
(ℓ)
![]() CH3COO–
(aq) +
H3O+
(aq)
CH3COO–
(aq) +
H3O+
(aq)
- Pour indiquer que la réaction s’effectue dans les deux sens.
- Pour la réaction entre le chlorure d’hydrogène et l’eau, la réaction ne s’effectue pas dans le sens inverse :
HCl (g) + H2O (ℓ) → Cl – (aq) + H3O+(aq) (1)
Cl- (aq) + H3O +(aq) → x (2)
- La réaction étant totale, on l’indique en écrivant :
HCl (g) + H2O (ℓ) → Cl – (aq) + H3O+(aq) (1)
1)- Taux d’avancement d’une réaction.
- Une transformation chimique n’est pas toujours totale.
- Dans ce cas, aucun des réactifs n’a totalement disparu lorsque le système cesse d’évoluer.
- L’avancement final est inférieur à l’avancement maximal.
- Pour pouvoir rendre compte de ce phénomène, on définit une nouvelle grandeur : le taux d’avancement d’une réaction.
- Le taux d’avancement d’une réaction, noté t, est le rapport entre son avancement final et son avancement maximal.
- 
- Si τ = 0, la réaction n’a pas lieu.
- Si τ = 1, la réaction est totale et si 0 < τ < 1, la réaction conduit à un équilibre chimique.
- On peut exprimer cette grandeur en pourcentage
- Le taux d’avancement final dépend de la nature et de la concentration de l’acide.
2)- Les réactions conduisant à une transformation totale.
- Une transformation est dite totale si l’avancement final de la réaction est égal à son avancement maximal :
- xf = xmax
- On la note avec une simple flèche :
A + B → C + D.
- À l’état final, le réactif limitant est entièrement consommé.
- La réaction inverse n’a pas lieu.
- Le taux d’avancement de la réaction est égal à 1 :
-

3)- Les réactions conduisant à un équilibre chimique.
- Une transformation mène à un équilibre chimique si l’avancement final de la réaction est inférieur à son avancement maximal
- xf < xmax.
- On note l’équation de la réaction avec le signe
(![]() ).
).
- On écrit :
A +
B
![]() C +
D.
C +
D.
- les réactifs et les produits coexistent à l’état final.
- Le système est alors dans son état d’équilibre chimique.
- Les deux réactions se produisent simultanément et annulent leurs effets.
- L’avancement final de la réaction peut être modifié par l’ajout d’un réactif ou d’un produit de la réaction.
- On dit dans ce cas que l’on déplace l’équilibre.
- Le taux d’avancement de la réaction est inférieur à 1 :
-

4)- Interprétation de l’équilibre chimique à l’échelle microscopique.
- Une réaction chimique peut s’interpréter au niveau microscopique comme résultant de chocs efficaces entre molécules de réactifs.
- Lorsque la réaction n’est pas totale, cela signifie que des chocs efficaces peuvent également se produire entre molécules de produits pour donner des réactifs.
- L’équilibre chimique est atteint lorsqu’en moyenne au cours du temps, il se produit autant de chocs efficaces entre les réactifs A et B qu’entre les produits C et D.
- On est en présence d’un équilibre chimique dynamique.
- Le milieu réactionnel est le siège d’une activité chimique permanente à l’échelle microscopique.
- À l’échelle macroscopique les effets de cette activité se compensent globalement.