|
TP
Chimie N° 02 |
Préparation
de solutions.
Correction.
Enoncé
|
|
|
Matériel :
|
deux
balances électroniques, béchers, coupelle ou verre de montre,
fiole
jaugée de 250 mL ou 100 mL, pipette jaugée de 10 mL et 20 mL,
entonnoir, pipette simple, pissette d’eau distillée.
|
|
solution
de chlorure de fer III de concentration C,
alcool à brûler, chlorure
de sodium solide.
|
Enoncé
|
Données
|
Na
|
O
|
C
|
H
|
S
|
Cu
|
Fe
|
Cl
|
|
Masses
molaires
g
/ mol
|
23,0
|
16,0
|
12,0
|
1,00
|
32,1
|
63,5
|
55,8
|
35,5
|
I-
But :
Préparer des solutions par dissolution d’un solide ou par
dilution d’une solution.

II-
Par dissolution d’un composé ionique solide.
1)-
Expérience.
 Prélever à l’aide d’une spatule un peu de chlorure de
sodium.
Prélever à l’aide d’une spatule un peu de chlorure de
sodium.
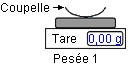
- Peser en utilisant une balance électronique et une coupelle ou un
verre de montre.
- Noter sa masse
m1 =
- introduire le
solide dans une fiole jaugée de volume
V
= 250 mL.
- rincer le récipient
utilisé et avec une pissette d’eau distillée.
- L’eau de rinçage doit
couler dans la fiole jaugée.
- remplir la fiole
jaugée environ aux ¾ avec de
l’eau distillée.
- agiter pour
accélérer la dissolution et homogénéiser la solution.
- compléter avec de
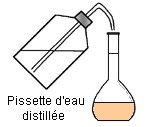
l’eau distillée jusqu’au trait de jauge.
- Ajuster au trait de jauge avec
une pissette d’eau distillée.
- boucher et agiter
pour homogénéiser. On obtient la solution
1.
2)-
Compte-rendu.
 Schématiser les opérations nécessaires à la préparation de
la solution 1
Schématiser les opérations nécessaires à la préparation de
la solution 1
en indiquant toute la verrerie utilisée.
|
Première étape :
à
l’aide d’une
balance électronique,
on détermine la valeur
de la
masse de soluté
|
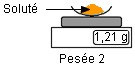
Deuxième étape :
on verse le soluté
dans la fiole jaugée
de volume
approprié
|
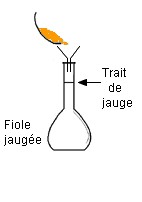
Troisième
étape :
On ajoute de
l’eau distillée
aux ¾ de la graduation.
|
|
|
|
|
|
Quatrième étape :
on agite pour
dissoudre,
mélanger et
homogénéiser
|
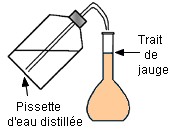
Cinquième étape :
On complète avec
une pissette
d’eau distillée
jusqu’au trait de jauge.
|
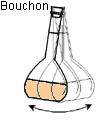
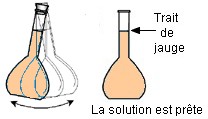
Sixième
étape :
on agite
pour
homogénéiser.
La solution est prête.
|
|
|
|
|
- Calculer le titre massique
tm et la concentration molaire
C
de la solution 1.
|
-
Titre massique de la solution :
|
|
m (S)
|
|
|
|
|
|
|
t
(S) =
|
|
|
|
|
|
|
|
|
V
|
|
|
|
|
|
|
|
1,21
|
|
|
t (S)
=
|
|
|
|
|
250,0
x
10 –
3
|
|
|
|
|
|
|
t (S)
≈
4,84
g / L |
|
|
- Concentration molaire de la solution de chlorure de
sodium :
- M(NaCl)
=
58,5 g
/ mol
- m
(S) =
n (S)
. M
(NaCl) et
- En combinant ces deux relations :
|
C (S)
=
|
m (S)
|
|
|
M
(NaCl) .
V
|
|
|
|
|
|
1,21
|
|
C (S)
=
|
|
|
|
58,5
x 0,250
|
|
|
|
|
C (S)
≈
|
8,27
x 10 – 2 mol / L
|
|
- Indiquer les espèces chimiques présentes dans la
solution
1.
|
-
Si le solide est du chlorure de sodium, la solution
contient des ions chlorure et des ions sodium.
- Si le solide est du chlorure de fer III.
-
La solution
contient des ions chlorure et des ions fer III. |
- Écrire l’équation simplifiée de la réaction
de dissolution du chlorure de sodium dans l’eau.
|
- Solution de chlorure de sodium :
-
NaCl
(s)
→
Na
+
(aq) +
Cl
– (aq)
|
- En déduire la concentration molaire des ions présents
dans la solution.
|
- Solution de chlorure de sodium :
- La solution contient autant d’ions chlorure que
d’ions sodium :
- C(s)
= [
Na
+
]
= [
Cl –
] ≈
8,27
x
10 – 2 mol /
L
|

III-
Par dilution d’un liquide.
1)-
Expérience.
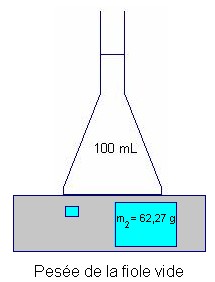
 Mesurer la masse
m 2 d’une fiole
jaugée de 100 mL vide.
Mesurer la masse
m 2 d’une fiole
jaugée de 100 mL vide.
 Prélever V0 =10,0 mL d’alcool à brûler commercial avec une pipette
jaugée munie de sa propipette.
Prélever V0 =10,0 mL d’alcool à brûler commercial avec une pipette
jaugée munie de sa propipette.
 Les introduire dans la fiole jaugée de 100 mL.
Les introduire dans la fiole jaugée de 100 mL.
 Ajouter de l’eau distillée aux ¾, homogénéiser, puis ajuster au
trait de jauge avec une pissette d’eau distillée.
Ajouter de l’eau distillée aux ¾, homogénéiser, puis ajuster au
trait de jauge avec une pissette d’eau distillée.
 Boucher et agiter doucement pour homogénéiser. On obtient la
solution
2.
Boucher et agiter doucement pour homogénéiser. On obtient la
solution
2.
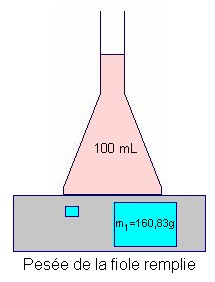
- Mesurer la masse
m3 de la fiole pleine.
2)-
Compte-rendu.
- Mode
opératoire
- L’alcool à brûler commercial contient principalement de l’éthanol.
- L’indication 90 ° signifie que l’alcool à brûler commercial contient
90 % en volume d’éthanol.
- Ce n’est pas un corps pur, c’est un mélange d’éthanol et d’eau.
|
Les pesées
|
|
|
|
a)- Déterminer le titre massique de la
solution
2 sachant que la masse volumique de l’éthanol est
μ = 0,79 g / mL.
|
- Volume
V
d’alcool pur utilisé : pourcentage en volume 90 %
- Masse
m(s)
d’alcool pur utilisé :
|
m (S)
=
|
μ .
V
|
|
=
|
90
|
|
|
.
V0 .
μ
|
|
100
|
|
|
|
90
|
|
|
|
|
|
m (S) =
|
|
x
|
|
0,79
|
x
10 |
|
|
100
|
|
|
|
|
|
|
|
|
|
|
|
|
m (S)
≈
7,1 g |
- Titre t(s)
massique de la solution :
|
|
m (S)
|
|
|
|
|
|
|
t
(S)
=
|
|
|
|
|
|
|
|
|
V
|
|
|
|
|
|
|
|
8,7
|
|
|
t (S)
=
|
|
|
|
|
100,0
x
10 -
3
|
|
|
|
|
|
|
t (S)
≈
71
g / L |
|
b)- Quelles sont les espèces présentes dans la solution
commerciale et dans la solution 2 ?
|
- Espèces présentes dans la solution :
- Éthanol
CH3CH2OH,
méthanol
CH3OH,
eau H2O,
et du diiode pour dénaturer l’alcool.
- Les solutions contiennent les mêmes espèces chimiques. |
c)-
Déterminer la valeur de la masse volumique de la
solution
2.
|
- Masse de la
solution 2 :
- m
= m1
– m2
=>
m = 160,83 – 62,27
- m
≈
98,56 g
- Masse volumique de la
solution 2.
|
|
m
|
|
|
|
|
|
|
μ
=
|
|
|
|
|
|
|
|
|
V
|
|
|
|
|
|
|
|
98,56
|
|
|
μ
=
|
|
|
|
|
100,0
|
|
|
|
|
|
|
μ
≈
0,9856
g / L |
|

IV-
Par dilution d’une solution mère.
1)-
Expérience.
 On dispose d’une solution mère de chlorure de fer
III
de concentration CM.
On dispose d’une solution mère de chlorure de fer
III
de concentration CM.
 On souhaite préparer par dilution, un volume
VF =100
mL d’une solution fille de concentration
On souhaite préparer par dilution, un volume
VF =100
mL d’une solution fille de concentration
 appelée
solution
3.
appelée
solution
3.
 Quel volume
VM
de solution mère faut-il prélever ?
Quel volume
VM
de solution mère faut-il prélever ?
|
- On doit effectuer une dilution car la concentration
molaire du soluté diminue.
- Lors d’une dilution, la concentration molaire du soluté
diminue, mais sa quantité de matière ne change pas.
- On dit qu’au cours d’une dilution, la quantité de
matière de soluté se conserve.
- La solution de départ est appelée la solution mère et
la solution diluée est appelée la solution fille.
|
SM
|
{
|
CM = |
Dilution |
SF
|
{
|
CF = |
|
VM = ? |
→ |
VF = |
|
nM
= CM . VM |
|
nF = CF . VF |
|
Solution
mère |
|
Solution
fille
|
- si
A
représente l’espèce présente dans la solution.
-
La
quantité de matière nA
de cette espèce est la même dans la solution mère
et dans la solution fille.
- Il y a conservation de la quantité de matière
de soluté :
- la quantité
de matière de soluté présente dans la solution mère :
nM
= CM
. VM
(1)
- la quantité
de matière de soluté présente dans la solution fille :
nF
= CF
. VF
(2)
- Conséquence :
CM
. VM
=
CF
. VF
avec obligatoirement :
VM
<
VF
|
 Effectuer la préparation de la
solution
3.
Effectuer la préparation de la
solution
3.
|

|
On ne pipette jamais
dans le récipient qui contient la solution mère
|
2)-
Compte-rendu.
 Schématiser les opérations nécessaires à la préparation de
la solution 3
en indiquant toute la verrerie utilisée.
Schématiser les opérations nécessaires à la préparation de
la solution 3
en indiquant toute la verrerie utilisée.
|
- Détermination du volume de solution mère nécessaire :
- De la relation (3), on tire :
|
|
CF
|
|
|
|
|
|
|
VM
=
|
|
.
|
VF
|
|
|
|
|
|
CM
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
VF
|
|
|
|
|
VM
=
|
|
|
|
|
|
|
10
|
|
|
|
|
|
|
|
|
|
|
VM
≈
10,0
mL |
-
Si la solution Mère a une concentration
CM
= 0,10 mol / L,
- La solution fille a une concentration CF = 0,010 mol
/ L. |
|
Première étape :
Verser
suffisamment
de solution Mère
dans un bécher
|
Deuxième étape :
On
prélève le
volume nécessaire
de solution Mère
à l’aide d’une
pipette jaugée munie
de sa propipette
|
Troisième
étape :
On
verse le volume
nécessaire de
solution
dans la
fiole jaugée de
volume approprié..
|
|
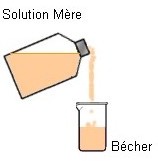
On
ne pipette
jamais directement
dans le flacon
qui contient
la solution
Mère
|

|

|
|
Quatrième étape :
On
ajoute de
l’eau distillée
et on agite
mélanger et
homogénéiser
|
Cinquième étape :
On
complète avec
une pissette
d’eau distillée
jusqu’au trait de jauge.
|
Sixième
étape :
on
agite pour
homogénéiser.
La solution est prête.
|
|


|

|

|
a)-
Déterminer la valeur du titre massique de la
solution
3.
|
Titre
massique de la solution 3.
- tm
= CF .
M
- tm
≈
0,010 x
162
- tm
≈
1,62 g / L
|
b)- Quelles sont les espèces présentes dans la solution mère et
dans la solution fille ?
|
- La solution mère et la solution fille contiennent les mêmes
espèces chimiques :
- Des ions chlorure, des ions fer III et des molécules
d’eau (solvant).
|
c)- Pour préparer la solution mère, on a utilisé du chlorure de fer
III
pentahydraté de formule :
(FeCl3,
5
H2O).
- C’est
un solide ionique.
- Quelle masse m
de chlorure de fer III
pentahydraté faut-il peser pour préparer 250 mL de solution mère ?
- On
donne la concentration de la solution mère :
CM = 0,10 mol /
L.
|
- Masse de chlorure de fer nécessaire :
- Avec :
m
= n
. M
et n
= C
. V
- m
= C
. V
. M
- m
≈
0,10 x 0.250
x (162 + 5
x 18)
- m
≈
6,3 g
|
d)-
Écrire l’équation de la réaction de dissolution.
- En déduire la
concentration molaire des ions présents dans la solution.
- Comparer
la (les) valeur (s) trouvée (s) à celle de la concentration de la solution mère.
- Conclusion.
|
- Réaction de dissolution :
|
|
H2O
|
|
|
(
FeCl3
, 5 H2O)
→ (
Fe3+
(aq)
+ 3 Cl–
(aq) )
|
|
|
(FeCl3,
5
H2O)
|
→
|
Fe3+ (aq)
|
3
Cl–
(aq)
|
|
Quantités
de matière
Avant
dilution
|
n
|
|
0
|
0
|
|
Quantités
de matière
Après
dilution
|
0
|
|
n
|
3
n
|
|
Concentrations
|
|
|
|
|
|
Solution
Mère
mol
/ L
|
CM =
0,10
|
|
[Fe
3+] =
CM =
0,10
|
[Cl–] =
3
CM =
0,30
|
|
Solution
fille
mol
/ L
|
CF =
0,010
|
|
[Fe3+] =
CF =
0,010
|
[Cl–] =
3
CF =
0,030
|
|

V-
Matériel et verrerie
utilisés en chimie.
|

|

|
|
|

|
|
|
 |
 |
|
 |
 |
Burette
Graduée
(Burette
de Mohr)
|











 appelée
appelée









