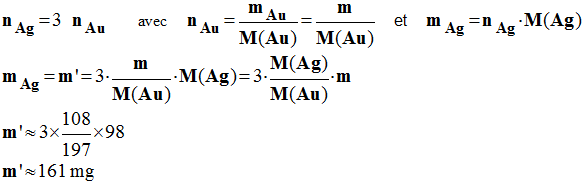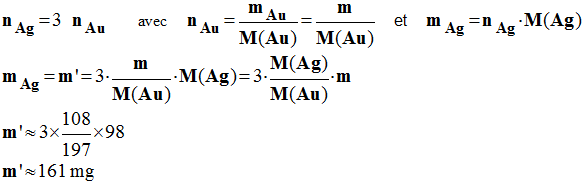|
Contrôle N° 03 décembre 1999 Première S énoncé et correction |
|
|
|
II- Équilibre d'un solide en l'absence de frottements. |
I- Interaction.

Un objet de masse m = 100 g est maintenu par
l'intermédiaire d'une ficelle (f). On note :
![]() , poids de l'objet,
, poids de l'objet,
![]() , la force exercée par l'objet
sur la ficelle et
, la force exercée par l'objet
sur la ficelle et
![]() , la force
exercée par la ficelle sur l'objet.
, la force
exercée par la ficelle sur l'objet.
Comparer P, F1 et F2 et justifier chaque fois la réponse :
1)- L'objet est immobile.
- L'objet est immobile : Le référentiel d'étude est le référentiel terrestre supposé Galiléen.
-
l'objet est soumis
à deux forces : son poids
 dû à
l'interaction avec la terre et la force
dû à
l'interaction avec la terre et la force
 exercée par la ficelle sur
l'objet.
exercée par la ficelle sur
l'objet.

- l'objet étant immobile, il est soumis à des forces dont les effets se compensent (principe de l'inertie) : P = F2.
-
D'autre part les forces
 et
et
 sont liées par le principe de
l'interaction : F1
= F2.
sont liées par le principe de
l'interaction : F1
= F2.
- En conséquence : P = F1 = F2.
2)- L'objet monte d'un mouvement rectiligne accéléré :
- L'objet monte d'un mouvement rectiligne varié.
-
L'objet n'est plus soumis à des forces dont les effets se
compensent :
 ,
,
- Mais F1 = F2 d'après le principe de l'interaction :
- On tire : P ≠ F2 = F1.
3)- L'objet descend d'un mouvement rectiligne uniforme.
- L'objet descend d'un mouvement rectiligne uniforme :
-
l'objet est soumis
à des forces dont les effets se compensent (principe de l'inertie) :
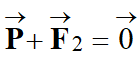
-
P = F2
et les forces  et
et
 sont liées par le principe de
l'interaction : F1
= F2.
sont liées par le principe de
l'interaction : F1
= F2.
- En conséquence : P = F1 = F2.
II- Équilibre d'un solide en l'absence de frottements.

Deux chariots sont placés sur un banc à coussin d'air incliné d'un angle α = 20° par rapport à l'horizontale.
Sur chaque chariot, on a fixé un aimant.
Le chariot B est immobilisé et le chariot A est en équilibre : m = 536 g et g = 10 N / kg.
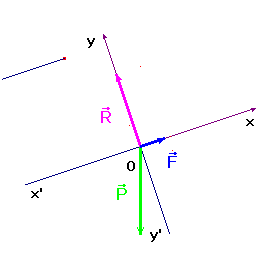
1)- Faire le bilan des forces agissant sur le chariot A.
Représenter ces forces dans le repère
 .
.
-
Bilan des forces : poids du système :
 , réaction du support
, réaction du support
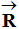 (la réaction est
perpendiculaire au support car les frottements sont négligeables) et la
force magnétique
(la réaction est
perpendiculaire au support car les frottements sont négligeables) et la
force magnétique
 . On représente
les forces dans le repère :
. On représente
les forces dans le repère :
 .
.
2)- Donner les conditions d'équilibre pour le chariot A.
- Conditions d'équilibre du chariot A :
-
La somme vectorielle des vecteurs forces appliquées au système
est égale au vecteur nul ( ) et
les lignes d'action des trois forces sont concourantes et coplanaires.
) et
les lignes d'action des trois forces sont concourantes et coplanaires.
3)- Donner l'expression littérale des coordonnées de chacune des
forces dans le repère
 .
.
-
Coordonnées de chacune des forces dans le repère
 .
.
-
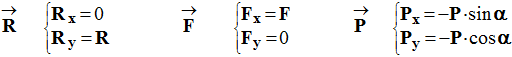
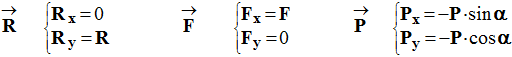
4)- En déduire la valeur de chacune des forces agissant sur le chariot A.
- Valeur de chacune des forces :
- Valeur du poids :
- P = m . g
- P ≈ 0,536 x 10
- P ≈ 5,4 N
- Valeur des autres forces :
-
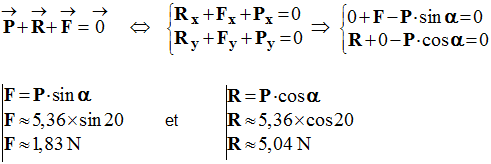
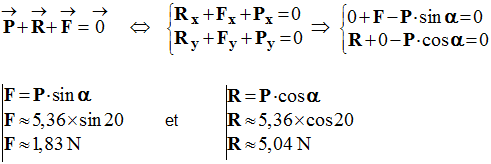
III- Action d'un acide sur un métal.
On introduit une masse m = 1,35 g de poudre d'aluminium dans un volume V = 100 mL d'une solution d'acide chlorhydrique de concentration C = 1,0 mol / L.
1)- Écrire l'équation bilan de la réaction. L'interpréter au sens de l'oxydoréduction.
- Équation bilan de la réaction :
2 Al
+ 6 H+ → 2 Al3+
+ 3 H2
- L'aluminium métal a été oxydé et l'ion hydrogène a été réduit.
2)- Calculer le volume de dihydrogène recueilli en fin de réaction (Vm = 24 L / mol dans les conditions de l'expérience). Justifier la réponse.
- Quantité de matière d'aluminium :
-
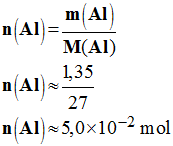
- Quantité de matière de H+ :
- n (H+) = C . V
- n (H+) ≈ 1,0 x 0,100
- n (H+) ≈ 0,10 mol
- Il faut comparer
-


- L'aluminium est en excès et H+ limite la réaction
-


3)- Déterminer la concentration des ions présents dans la solution en fin de réaction.
- Concentration : H+ a disparu car il a totalement réagi.
- L'ion chlorure est spectateur sa concentration ne varie pas, on considère que le volume de la solution n'a pas varié : [Cl–] ≈ 1,0 mol / L.
- Concentration des ions aluminium :
-
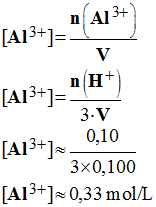
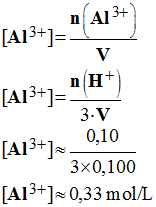
IV- Une pile qui vaut de l'argent. (Une autre solution)
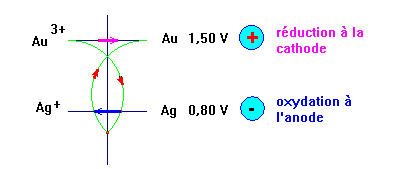
On réalise une pile en associant les deux demi-piles faisant intervenir les couples oxydant / réducteur suivants :
Au3+ / Au et Ag+ / Ag
1)- Dessiner cette pile, indiquer la polarité des électrodes et déterminer sa f.e.m. Donner son schéma conventionnel.
- Dessin : l'électrode d'or constitue le pôle plus de la pile et l'électrode d'argent constitue le pôle moins de la pile.

- Schéma conventionnel :
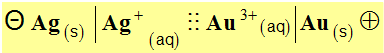
- La force électromotrice :
- e Ag–Au = E0 (Au3+ / Au) – E0 (Ag+ / Ag)
- e Ag–Au ≈ 1,50 – 0,80
- e Ag–Au ≈ 0,70 V
2)- nommer chaque électrode, donner les réactions aux électrodes et indiquer s'il s'agit d'une réduction ou d'une oxydation.
- à la cathode se produit une réduction :
Au3+
+ 3 e– → Au
- à l'anode se produit une oxydation :
Ag
→ Ag+ + e–
3)- Écrire l'équation bilan de la réaction qui s'effectue lorsque la pile débite du courant.
|
|
Au3+ |
+ |
3 e– |
= |
Au |
|
|
|
|
|
3 |
( |
Ag |
= |
e– |
+ |
Ag+ |
) |
|
|
Au3+ |
+ |
3
Ag |
→ |
Au |
+ |
3
Ag+ |
|
4)- On laisse la pile fonctionner pendant Δt = 3,0 h. On constate que la masse de l'électrode d'or a varié de m = 98 mg.
a)- La masse de l'électrode d'argent a-t-elle augmenté ou diminué ? Calculer la variation de masse m' de l'électrode d'argent.
- Au cours de la réaction, de l'argent disparaît, la masse de l'électrode d'argent diminue.
- D'après de bilan des quantités de matière de l'équation bilan de la réaction :
-