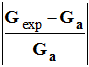|
Anabac Sciences Physiques Pondichéry 2012 Exercice 2 Énoncé et correction |
|
|
|
|
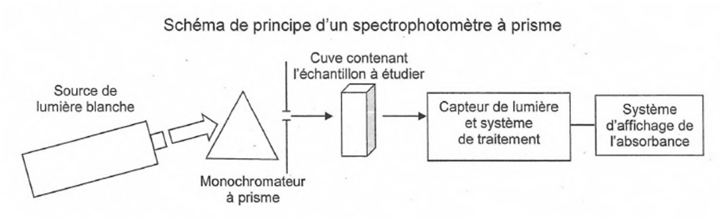
Exercice 2 : Spectrophotométrie (5,5 pts)
1ière partie : lumière et spectrophotométrie. |
Exercice 2 : Spectrophotométrie (5,5 pts)
|
La lumière est un « outil » précieux en chimie analytique. En effet, toute espèce chimique est susceptible d’interagir avec des radiations lumineuses. Par exemple, une
espèce colorée
X absorbe
certaines radiations visibles. Le principe de la spectrophotométrie repose sur la mesure de l’absorbance A de l’espèce X en solution dans un solvant Y. Cette grandeur A est le résultat de la comparaison de deux intensités lumineuses : celle d’une radiation monochromatique ayant traversé une cuve transparente contenant le solvant Y,
et celle de la même radiation émergeant
de la même cuve contenant la solution de l’espèce
X
dans le
solvant
Y. |
1. 1ière partie : lumière et spectrophotométrie.
|
1.1. Donner les valeurs limites des longueurs d’onde du spectre
visible dans le vide et les couleurs
correspondantes.
1.2. Situer, du point de vue de leur longueur d’onde, les
rayonnements ultraviolets et
infrarouges par rapport au spectre visible. 1.3. Le rôle du monochromateur dans un spectrophotomètre est de sélectionner une radiation monochromatique particulière. Donner la définition d’une lumière monochromatique. 1.4. Certains monochromateurs comportent un prisme de verre. 1.4.1. Définir l’indice de réfraction n d’un milieu transparent.
1.4.2. De quel paramètre caractéristique d’une radiation
lumineuse dépend l’indice n
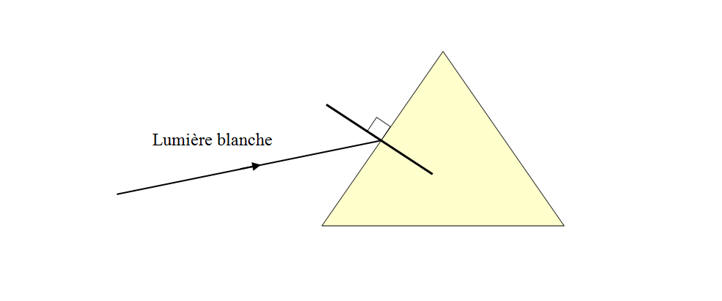
pour un milieu transparent donné ? 1.4.3. Le prisme de verre décompose la lumière blanche. Nommer le phénomène responsable de cette décomposition et le décrire brièvement en quelques lignes. 1.4.4. Lors d’une réfraction air-verre, la déviation d’une radiation lumineuse est d’autant plus importante que la longueur d’onde de la radiation est faible. Sans faire de calcul, compléter la figure de la feuille annexe (à rendre avec la copie) en y faisant figurer le trajet d’un rayon lumineux bleu et d’un rayon
rouge à l’intérieur du prisme et
après sa sortie. |
2. 2ième partie : Dosage colorimétrique par étalonnage.
|
On se propose de déterminer la concentration en diiode dans une teinture d’iode officinale. On commence par diluer 200 fois la teinture d’iode (trop concentrée pour une étude spectrophotométrique directe). La solution aqueuse obtenue à l’issue de cette dilution est appelée solution S. Par ailleurs, on dispose d’un ensemble de solutions aqueuses de diiode notées Di (D1, D2, etc.) de concentrations connues toutes différentes. Ces solutions ont des colorations proches de celle de la solution S. |
Données :
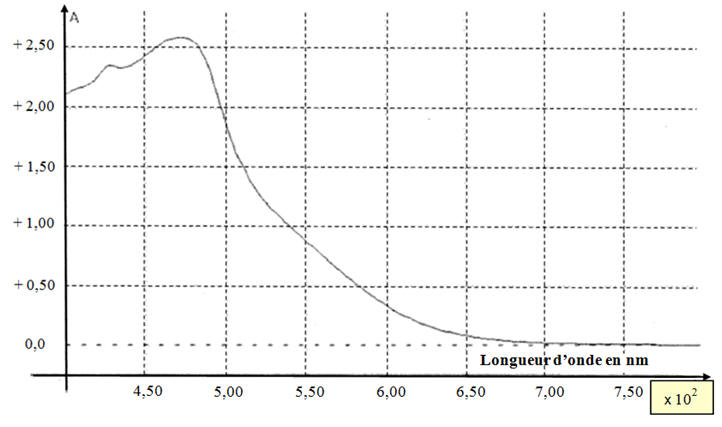
Spectre d’absorption d’une solution aqueuse de diiode
de concentration molaire
C = 3,0
× 10
– 3 mol.L–1
Masse molaire atomique de l’iode : 127 g.mol-1
|
Écart relatif entre une valeur expérimentale
Gexp
et une valeur attendue Ga d’une grandeur quelconque
G :
2.1. On peut trouver expérimentalement un encadrement de la concentration en diiode de la solution S, sans utiliser un spectrophotomètre. 2.1.1. Expliquer brièvement la méthode. 2.1.2. Pourquoi lors de la mise en œuvre de cette méthode, faut-il que les récipients utilisés (tubes à essais ou béchers) soient tous identiques ?
2.2. À l’aide d’un spectrophotomètre, on mesure l’absorbance
Ai de
chaque solution
Di
de diiode, puis celle de la
solution S.
2.2.1. Donner la valeur d’une longueur d’onde qui vous paraît
bien appropriée pour ces mesures.
Justifier brièvement. 2.2.2. On obtient les résultats suivants :
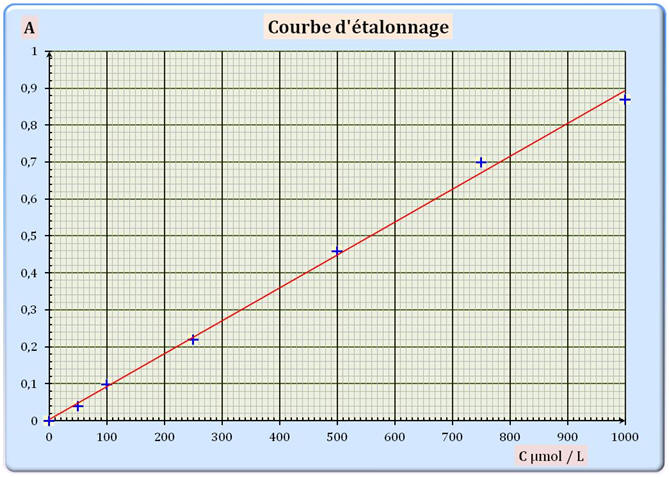
Absorbance de la solution S : A = 0,78. La courbe d’étalonnage de l’absorbance en fonction de la concentration molaire C en diiode est fournie en annexe.
La relation
entre l’absorbance A et la concentration
C est appelée loi
de Beer-Lambert. Elle s’écrit : A = k . C avec k une constante et C la concentration molaire de l’espèce colorée dans la solution.
La courbe d’étalonnage obtenue est-elle en accord avec cette
loi ? Justifier 2.2.3. Déterminer graphiquement la concentration molaire CS.exp en diiode de la solution S. En déduire la concentration molaire Cexp en diiode de la teinture d’iode officinale.
2.3. La teinture d’iode officinale est étiquetée à 5,0 % en
masse de diiode. Sa masse volumique
est
ρ = 9,0 x 102
g . L– 1.
2.3.1. À partir de ces données, vérifier que la concentration
massique Cm en diiode
attendue dans cette teinture est 45
g . L– 1.
2.3.2. En déduire la valeur de la concentration molaire attendue
en diiode dans cette
teinture. On
la notera Ca. 2.3.3. Calculer l’écart relatif entre la valeur expérimentale Cexp à la valeur Ca. Conclure. |
Questions 2.2.2 et 2.2.3 : Courbe d’étalonnage :
|
|
|
|