|
Contrôle N° 03 Décembre 2000 énoncé et Correction |
|
|
|
I-
Le contre au Basket.
|
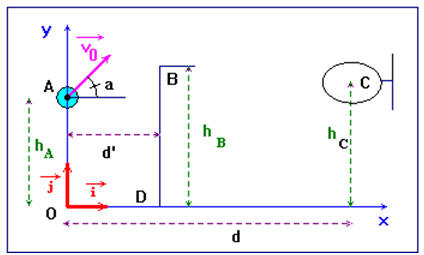
On étudie la trajectoire du centre d'inertie d'un ballon de basket-ball lancé par un joueur. On ne tiendra pas compte ni de la résistance de l'air, ni de la rotation éventuelle du ballon sur lui-même. Le lancer est effectué vers le haut ; on lâche le ballon lorsque son centre d'inertie est en A (voir schéma). Sa vitesse initiale est représentée par le
vecteur
et faisant un angle α avec l'axe horizontal. 1)- Établir les équations horaires du mouvement du centre d'inertie du ballon. En déduire l'équation de la trajectoire. 2)- Calculer la vitesse initiale du ballon, pour que celui-ci (le centre d'inertie du ballon) passe exactement par le point C, centre du panier. 3)- Un défenseur BD, placé entre l'attaquant et le panneau de basket saute verticalement pour intercepter le ballon : l'extrémité de sa main se trouve en B à l'altitude hB = 3,10 m. A quelle distance horizontale maximale d' de l'attaquant doit-il se trouver pour toucher le ballon du bout des doigts ? - Données : g = 9,8 m / s2 ; α = 40 °; diamètre du ballon : 25 cm ;
-
hA = 2,40 m ; hB =
3,10 m ;
hC = 3,05 m ; d = 6,25
m |
II-
Canon
à électrons.
|
Dans un canon à électrons, la tension entre l'anode A et la cathode C est UAC = 9000 V.
1)- Faire un schéma du dispositif et représenter le
vecteur champ
électrique
2)- Exprimer la variation d'énergie cinétique d'un électron entre son départ de la cathode C et son arrivée au niveau de l'anode A. 3)- Calculer la valeur de la vitesse vA au niveau de l'anode, l'énergie cinétique initiale de l'électron étant négligeable devant l'accroissement de l'énergie cinétique. - Charge élémentaire : e = 1,6 × 10 –19 C ; - Masse de l'électron me = 9,1 × 10 –31 kg. |
III-
Réaction acide-base.
|
1)- Tracer les domaines de prédominance relatifs des couples HF / F – ; pKA1 = 3,2 et CH3NH3+ / CH3NH2 ; pKA2 = 10,6. 2)- On mélange 50 mL de solution d'acide fluorhydrique de concentration C = 1,0 × 10 –1 mol / L et 50 mL de solution de méthanamine de concentration C' = 1,0 × 10 –1 mol / L. a)- Quelle est la réaction qui a lieu ? Calculer sa constante KR. Conclure. b)- Quelles sont les espèces prédominantes en fin de réaction ? calculer leurs concentrations. |
IV- Il ne faut pas faire de mélange. Corrigé
|
On mélange les solutions suivantes :
1)- Indiquer les réactions prépondorantes successives. Les qualifier. 2)- Quel est le couple acido-basique dont les deux espèces sont majoritaires ? Justifier. 3)- En déduire la valeur du pH de la solution. Justifier. |