|
Contrôle N° 01 : Septembre 1999
Énoncé et
Correction |
|
|
|
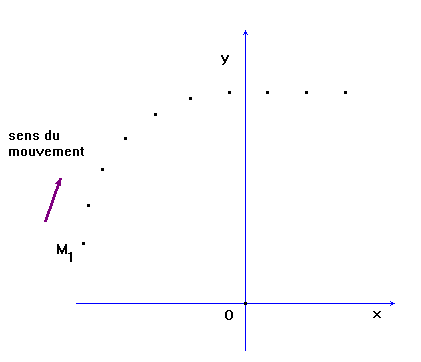
On considère sur une table horizontale un mobile autoporteur de masse m = 536 g. Après lancement du mobile, on enregistre à intervalles de temps égaux τ, τ = 25,8 ms, les positions successives d'un point du solide. L'enregistrement obtenu est représenté
en vraie grandeur ci-dessous. Définir les termes suivants : référentiel,
solide. 1)- À partir de l'enregistrement et
en indiquant la méthode utilisée, déterminer pour la position
M3 la valeur de
la vitesse v3. 2)- Tracer le vecteur vitesse
1 cm
↔ 0,1 m / s 3)- Déduire du tracé les
coordonnées cartésiennes du vecteur vitesse
|
Correction
|
1)- Définitions : - Référentiel : Système matériel par rapport auquel on étudie le mouvement d'un objet appelé mobile. Le mouvement d'un point mobile dépend du référentiel d'étude. - Solide : système matériel indéformable ( la distance entre deux quelconques de ses points restent à la même au cours du temps). 2)- Détermination de la valeur de la vitesse à l'instant t3. - La vitesse du point mobile à l'instant t3 est pratiquement égale à la vitesse moyenne calculée pendant un intervalle de temps très court encadrant l'instant considéré. On écrit :
3)- Tracé du vecteur : Il faut utiliser l'échelle donnée dans l'énoncé : 1 cm <==> 0,1 m / s
4)- Coordonnées cartésiennes du vecteur vitesse : Dans un premier temps, on détermine la longueur de chaque représentant puis en utilisant l'échelle, on en déduit la valeur des coordonnées du vecteur vitesse. Les coordonnées sont des grandeurs algébriques et l'unité est le m / s.
|
II- Préparation de la solution.
|
En dissolvant une masse m = 3,2 g de chlorure de cuivre II pentahydraté (CuCl2, 5 H2O), On obtient un volume
V = 500
mL de solution
A. Masses
molaires :
M (Cu) = 63,5 g / mol ; M (Cl) = 35,5 g / mol ; M (H2O)
= 18,0
g / mol. 1)-
Écrire l'équation bilan de dissolution. 2)-
Calculer la concentration molaire de la solution
A. 3)-
Calculer la concentration molaire des ions
présents dans la solution A.
|
Correction
|
1)- Équation bilan de la réaction : on doit dissoudre du chlorure de cuivre II pentahydraté.
2)- Concentration molaire de la solution A : - Masse molaire du chlorure de cuivre pentahydraté :
M
= M (Cu)
+ 2 M (Cl)
+ 5 M (H2O)
M
= 63,5 + 2 x 35,5 + 5 x 18,0
M
≈ 224,5
g
M
≈ 225
g - Quantité de matière dissoute :
- Concentration de la solution :
3)- Concentration molaire volumique : D'après le bilan molaire de la réaction de dissolution :
[Cl
–] = 2 C ≈ 2
×
2,9
× 10 –2
[Cl –] ≈ 5,8
× 10
–2 mol / L
[Cu2+] =
C ≈ 2,9
× 10 –2 mol / L |
III- Utilisation d'une solution commerciale.
|
On dispose d’une solution commerciale d’acide
chlorhydrique. Données : densité de la solution commerciale : d = 1,18 ; masse volumique de l’eau
μ0
= 1,00 kg / dm3 Pourcentage massique d’acide chlorhydrique (HCl) :
P (HCl)= 33,0
% Masses molaires :
M (H) = 1 g / mol
et M (Cl) = 35,5 g / mol. 1)-
Calculer la masse
m d’un litre de solution
commerciale. 2)-
En déduire la masse
m1, d’acide
chlorhydrique, présente dans un litre de solution commerciale. 3)-
En déduire le titre massique
tm et la
concentration molaire C de
la solution commerciale. 4)-
À l’aide de cette solution commerciale, on souhaite
préparer un volume V’
= 100 mL de solution S' de
concentration Décrire de manière détaillée les étapes de cette
préparation et le matériel utilisé. Justifier le choix du
matériel. |
Correction
|
1)- Masse de un litre de solution commerciale : m =
μ .
V = μ0 .
d . V m ≈ 1,00
× 1,18
× 1,00 2)- Masse d'acide chlorhydrique présente dans un litre de solution commerciale :
3)- Titre massique de la solution commerciale :
Concentration molaire volumique de la solution commerciale :
4)- Préparation de la solution diluée :
- On va utiliser le fait qu'au cours de la dilution, il y a conservation de la quantité de matière de soluté.
- Matériel nécessaire : - paire de gants et paire de lunettes ( la solution est très concentrée ). - bécher, pipette jaugée de 5 mL, fiole jaugée de 100 mL, propipette. - eau distillée et solution commerciale de détartrant. Mode opératoire : - On verse environ 10 mL de solution mère dans un bécher de 100 mL. - On prélève 5 mL de la solution mère à l'aide de la pipette jaugée de 5 mL, munie de sa propipette. - On verse lentement les 5 mL dans une fiole jaugée de 100 mL contenant un peu d'eau distillée. - On rajoute de l'eau distillée aux 3/4 environ. - On mélange, puis on rajoute de l'eau distillée jusqu'au trait de jauge à l'aide d'une pissette. - On homogénéise en fin d'opération. |
|
|
|
|