|
Contrôle N° 01 : Septembre 1999
Énoncé
et
Correction |
|
|
|
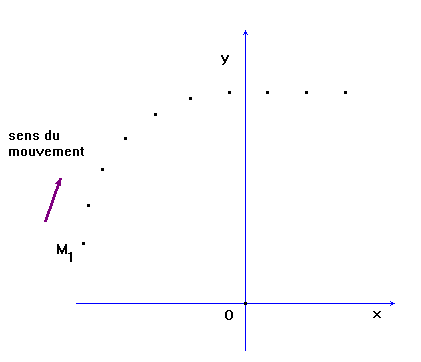
On considère sur une table horizontale un mobile autoporteur de masse m = 536 g. Après lancement du mobile, on enregistre à intervalles de temps égaux τ, τ = 25,8 ms, les positions successives d'un point du solide. L'enregistrement obtenu est représenté
en vraie grandeur ci-dessous. Définir les termes suivants : référentiel,
solide. 1)- À partir de l'enregistrement et
en indiquant la méthode utilisée, déterminer pour la position
M3 la valeur de
la vitesse v3. 2)- Tracer le vecteur vitesse
1 cm
↔ 0,1 m / s 3)- Déduire du tracé les
coordonnées cartésiennes du vecteur vitesse
|
II- Préparation de la solution.
|
En dissolvant une masse m = 3,2 g de chlorure de cuivre II pentahydraté (CuCl2, 5 H2O), On obtient un volume
V = 500
mL de solution
A. Masses
molaires :
M (Cu) = 63,5 g / mol ; M (Cl) = 35,5 g / mol ; M (H2O)
= 18,0
g / mol. 1)-
Écrire l'équation bilan de dissolution. 2)-
Calculer la concentration molaire de la solution
A. 3)-
Calculer la concentration molaire des ions
présents dans la solution A.
|
III- Utilisation d'une solution commerciale.
|
On dispose d’une solution commerciale d’acide
chlorhydrique. Données : densité de la solution commerciale : d = 1,18 ; masse volumique de l’eau
μ0
= 1,00 kg / dm3 Pourcentage massique d’acide chlorhydrique (HCl) :
P (HCl)= 33,0
% Masses molaires :
M (H) = 1 g / mol
et M (Cl) = 35,5 g / mol. 1)-
Calculer la masse
m d’un litre de solution
commerciale. 2)-
En déduire la masse
m1, d’acide
chlorhydrique, présente dans un litre de solution commerciale. 3)-
En déduire le titre massique
tm et la
concentration molaire C de
la solution commerciale. 4)-
À l’aide de cette solution commerciale, on souhaite
préparer un volume V’
= 100 mL de solution S' de
concentration Décrire de manière détaillée les étapes de cette
préparation et le matériel utilisé. Justifier le choix du
matériel. |
|
|
|
|