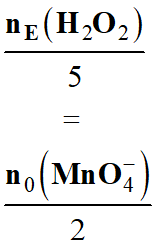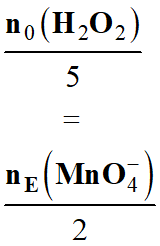|
QCM N° 18 |
Contrôle de la qualité par dosage |
|
|
|
QCM N° 18 : Contrôle de la qualité par dosage
: Pour chaque question, indiquer la
(ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Le graphe ci-dessous a été obtenu lors d’un dosage par conductimétrie. Ce graphe : |
Est une courbe d’étalonnage |
Vérifie la loi de
Kohlrausch. |
Vérifie la loi de Beer-Lambert. |
AB |
|
2 |
Pour le graphe ci-dessus, l’équation de la courbe est : |
σ
= 5,0 . C |
C
= 5,0 . σ |
σ
= 0,20 . C |
C |
|
3 |
La droite d’étalonnage d’un dosage spectrophotométrique : |
A un coefficient directeur sans unité. |
Est la droite représentative
de σ = f (C) |
Est la droite représentative
de A = f (C) |
C |
|
4 |
Un dosage par titrage direct met
en jeu : |
Une réaction chimique. |
Deux réactions chimiques. |
Un réactif titrant et un réactif titré. |
AC |
|
5 |
Une réaction support de dosage par titrage direct doit être : |
Lente et totale. |
Rapide et totale. |
Rapide et limitée. |
B |
|
6 |
À l’équivalence d’un titrage : |
Le volume du réactif titrant est égal au volume du réactif titré. |
Un mélange équimolaire des réactifs est réalisé. |
Un mélange stœchiométrique des réactifs est réalisé. |
C |
|
7 |
Une solution d’eau oxygénée est dosée par une solution de permanganate de potassium contenue dans une burette graduée. L’équation support du titrage est : 2 MnO4– (aq) + 5 H2O2 (aq) + 6 H+ (aq) → 2 Mn2+ (aq) + 5 O2 (aq) + 8 H2O (ℓ) |
|
|
|
C |
|
8 |
L’équivalence d’un titrage conductimétrique est repérée grâce : |
Au changement de pente du graphe
σ =f (Vréactifajouté) |
À la méthode des tangentes parallèles. |
À l’utilisation d’un indicateur de fin de réaction. |
A |
|
9 |
L’équivalence d’un titrage pH-métrique peut être repérée grâce à :
|
La méthode des tangentes parallèles. |
L’utilisation d’un indicateur coloré acido-basique quelconque. |
La méthode de la courbe dérivée. |
AC |
|
10 |
Lors d’un titrage colorimétrique d’une solution de diiode, on ajoute un peu de thiodène à cette solution pour repérer l’équivalence. Le thiodène : |
Est un indicateur de fin de réaction. |
Est le réactif
titré |
Permet de mieux repérer l’équivalence. |
AC |
►
Loi de Beer-Lambert.
-
Définition :
- L’absorbance d’une solution diluée contenant une espèce colorée est proportionnelle
à la concentration (effective) C de cette espèce
et à l’épaisseur
ℓ (cm) de
la solution traversée par le faisceau lumineux.
-
A (λ) =
ε (λ) . ℓ . C
-
ε (λ) est appelé coefficient
d’extinction molaire ou coefficient d’absorption molaire.
-
Il dépend de la nature de l’espèce dissoute et de
la longueur d’onde de la radiation utilisée.
-
Il dépend également du solvant et de la
température.
-
Unité :
-
A sans unité ;
ℓ en cm et
ε (λ)
en mol – 1.L.cm
– 1.
-
La courbe
A =
f (C) constitue
la courbe d’étalonnage de la substance étudiée.
-
Elle permet de déterminer la concentration d’une
solution de la substance étudiée.
-
Elle permet donc de doser une espèce chimique
colorée.
►
Loi de Kohlrausch :
-
La conductivité
σ d’une solution diluée
d’une espèce ionique dissoute est proportionnelle à sa
concentration molaire en soluté apporté :
-
σ =
k .
C.
|
σ
= k . C |
C ; concentration en mol
. L – 1 |
|
k : coefficient de proportionnalité en S . L . m – 1. mol
– 1 |
|
|
σ : conductivité de la
solution en S . m – 1 |
-
À partir de la mesure de la conductivité d’une
solution, on peut déterminer la valeur de sa concentration.
-
Remarque :
-
Les lois de Beer-Lambert et Kohlrausch ont des
équations analogues.
-
La solution colorée doit être suffisamment diluée,
C ≤ 1,0
× 10–2 mol . L–1, et ne doit
contenir qu’un seul soluté ionique.
-
La courbe obtenue est une portion
de droite passant par l’origine. La conductivité σ est
proportionnelle à la concentration C de la solution.
-
Le coefficient de
proportionnalité est égal au coefficient directeur de la droite.
-
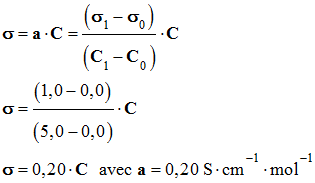
►
Dosage par titrage direct.
-
Un dosage par titrage direct met en jeu une
réaction chimique.
-
La réaction de support de dosage est une
réaction : totale, rapide, unique.
-
C’est une réaction quantitative.
-
Un réactif titrant, de concentration connue,
réagit avec un réactif titré dont on cherche la concentration.
►
Équivalence d’un titrage.
-
L’équivalence d’un titrage est atteinte lorsque le
réactif titrant et le réactif titré sont dans les proportions
stœchiométriques.
-
Les deux réactifs sont alors totalement consommés.
Ils ont totalement disparu.
- Le repérage de l’équivalence dépend de la technique de dosage utilisée.
►
Eau oxygénée dosée par une solution de
permanganate de potassium contenue dans une burette graduée
-
Tableau réduit :
►
Cas d’un titrage conductimétrique.
-
Principe :
-
Un titrage conductimétrique peut être envisagé
lorsque la réaction support de titrage fait intervenir des ions.
-
Si au cours d’un titrage conductimétrique la
dilution est négligeable, le graphe
σ =
f (Vréactif
ajouté) est constitué de deux droites.
-
Le point d’intersection de ces droites permet de
repérer l’équivalence du titrage.
-
Exploitation d’un graphe
σ =
f (Vréactif
ajouté) :
►
Cas d’un titrage par pH-métrie.
-
Principe :
-
Un titrage pH-métrique peut être envisagé lorsque
la réaction support du titrage est une réaction acido-basique.
-
On décompose la représentation graphique en trois
parties :
►
Détermination graphique du point d’équivalence E
:
-
Le point d’équivalence est le point d’inflexion de
la courbe pH = f
(V B).
-
On utilise la méthode des tangentes ou la fonction
dérivée
![]() pour
déterminer ses coordonnées.
pour
déterminer ses coordonnées.
-
Au point d’équivalence, on change de réactif
limitant et la courbe change de concavité.
-
Le point d’équivalence est caractérisé par ses
coordonnées : pH
E et
VBE.
-
On peut aussi utiliser un indicateur coloré
acido-basique adapté.
-
Un indicateur coloré convient pour un dosage
acido-basique si sa zone de virage contient la valeur du
pH du mélange
réactionnel à l’équivalence.
►
Cas d’un dosage colorimétrique.
-
Principe :
-
Lors d’un titrage colorimétrique, un changement de
teinte du mélange réactionnel permet de repérer l’équivalence.
-
Ce repérage peut être facilité par l’utilisation
d’un indicateur de fin de réaction.
-
Exemple : titrage colorimétrique du diiode par une
solution de thiosulfate de sodium.
-
Au départ, la solution a la teinte suivante :

-
On verse progressivement la solution de
thiosulfate de sodium (contenue dans la burette graduée) dans
l’erlenmeyer, tout en agitant.
-
La solution de
S1 de diiode {I2
(aq)} se décolore progressivement.
- Pour que l'indicateur qui permet de repérer l'équivalence soit performant,
- il faut en verser quelques gouttes juste avant l'équivalence lorsque la solution est jaune paille
- (on peut faire plusieurs dosages pour améliorer la
technique).
-
Teinte du mélange réactionnel avant l’ajout de
thiodène :

-
Après l’ajout de thiodène, le mélange réactionnel
prend une teinte bleue-violacée.

-
À l’équivalence, le mélange réactionnel prend la
teinte suivante :

-
Le thiodène permet de mieux repérer l’équivalence.
|
|