|
QCM N° 06 |
Titrages acido-basiques |
|
|
|
QCM N° 06 :
|
|||||
|
Énoncé |
A |
B |
C |
R |
|
|
1 |
Pour réaliser un montage afin d’effectuer le dosage pH-métrique, il faut utiliser : |
Une pipette graduée |
Une éprouvette graduée |
Une burette graduée |
C |
|
2 |
On réalise le suivi pH-métrique du dosage de l’acide chlorhydrique par la soude. À l’équivalence, la courbe représentant l’évolution du pH en fonction du volume VB de soude versé présente : |
Un bond de pH |
Un saut de pH |
Un pic de pH |
B |
|
3 |
La formule de la solution aqueuse de soude est : |
NaOH (aq) |
NaOH (s) |
{Na+ (aq) + HO– (aq)} |
C |
|
4 |
La formule de la solution d’acide chlorhydrique est : |
{H3O+ (aq) + Cl– (aq)} |
HCl (aq) |
HCl (g) |
A |
|
5 |
L’équation de la réaction de dosage de l’acide chlorhydrique par la soude est : |
|
H3O+ (aq) + HO– (aq) → 2 H2O ((ℓ) |
|
B |
|
6 |
Plus généralement, l’équation de la réaction de dosage d’un acide AH par la soude est : |
|
|
AH (aq) + H2O (ℓ) → A– (aq) + H3O+
(aq)
|
C |
|
7 |
Lorsque l’on dose une solution d’acide chlorhydrique par de la soude, à l’équivalence le : |
pH
> 7 |
pH = 7 |
pH < 7 |
B |
|
8 |
À l’équivalence du dosage d’un acide par la soude, la dérivée de la courbe pH = f (VB) donnant l’évolution du pH en fonction du volume de soude versé est : |
À son maximum |
À son minimum |
nulle |
A |
|
9 |
Une réaction de dosage : |
Est totale, rapide, unique |
À un taux d’avancement final inférieur à 1 |
À une constante d’équilibre K supérieure à 104 |
AC |
|
10 |
On dose un acide AH par une base B. À l’équivalence : |
L’acide et la base ont été mélangés dans les proportions stœchiométriques de la réaction |
La quantité de matière d’acide apporté est égale à la quantité de matière de base apportée |
Le pH est toujours égal à 7 |
AB |
|
|
|
||||
|
11 |
La courbe ci-dessus représente l’évolution du pH en fonction du volume de soude versé pour le dosage d’une solution d’acide chlorhydrique. On peut repérer l’équivalence à l’aide : |
De la valeur du coefficient directeur de la tangente à l’origine |
À l’aide de la méthode des tangentes |
À l’aide de la méthode de la moyenne |
B |
|
12 |
Les coordonnées du point d’équivalence E de la courbe précédente sont : |
pHE ≈ 7,0 VBE ≈ 9,8 mL |
pHE ≈ 8,0 VBE ≈ 9,8 mL |
pHE ≈ 7,0 VBE ≈ 12 mL |
A |
|
13 |
Les indicateurs colorés sont : |
Des espèces chimiques acido-basiques |
Des espèces chimiques oxydant-réducteur |
Des espèces chimiques neutres |
A |
|
|
|
||||
|
14 |
La courbe ci-dessus représente l’évolution du pH en fonction du volume de soude versé lors du dosage acido-basique. On dispose de trois indicateurs colorés dont on donne les caractéristiques ci-dessus. Pour réaliser le même dosage avec un indicateur coloré, il faut utiliser : |
La phénolphtaléine |
L’hélianthine |
Le Bleu de bromothymol (B.B.T) |
C |
|
15 |
On a dosé 10,0 mL d’une solution SA d’acide, de concentration inconnue, par 15,0 mL d’une solution SB de soude de concentration CB = 0,20 mol / L. La concentration de la solution dosée est : |
CA ≈ 0,13 mol / L |
CA ≈ 0,30 mol / L |
CA ≈ 0,3 mol / L |
B |
|
16 |
La réaction entre un acide et une base servant de support à un dosage est : |
Toujours totale |
Toujours limitée |
Parfois totale, parfois limitée, cela dépend de l’acide et de la base |
A |
|
17 |
À l’équivalence, le taux d’avancement final de la réaction acide base support du dosage est : |
Inférieur à 1 |
Égal à 1 |
Supérieur à 1 |
B |
|
18 |
On réalise le dosage de l’acide éthanoïque par une solution aqueuse de soude. À l’équivalence, le pH du point d’équivalence est : |
Inférieur à 7 |
Supérieur à 7 |
Égal à 7 |
B |
|
19 |
On réalise, le dosage d’une solution d’ammoniac NH3 (aq) par de l’acide chlorhydrique. À l’équivalence : |
On est en présence d’une solution aqueuse de chlorure d’ammonium |
Le pH du mélange réactionnel est inférieur à 7 |
Le pH du mélange réactionnel est supérieur à 7 |
AB |
|
20 |
|
Une pipette graduée |
Une éprouvette graduée |
une pipette jaugée |
|
Dispositif expérimental pour réaliser un dosage pH-mérique :
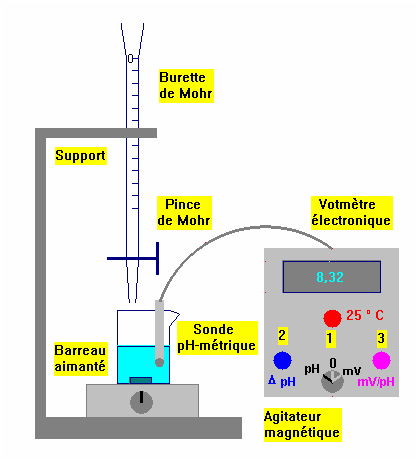
-
On verse progressivement la solution de soude dans
la solution d'acide et on relève la valeur du
pH après
chaque ajout. Il faut adapter les volumes
VB
versés aux variations de
pH.
- Le pH augmente lors de l’addition d’un volume VB de soude.
- Au départ, le pH est faible.
- Il augmente d’abord lentement car l’acide est en excès par rapport à la base. La base est le réactif limitant.
- Le pH augmente d’autant plus que l’excès d’acide se réduit.
- On observe un saut de pH de plusieurs unités.
- Ce saut de pH provient du changement de réactif limitant.
- La courbe change de concavité, elle possède un point d’inflexion E.
- Ce point particulier est appelé point d’équivalence, noté E.
- En ce point, on change de réactif limitant. On passe d’un excès d’acide à un excès de base.
- Puis l’acide est le réactif limitant et la base est le réactif en excès.
- Cet excès impose un pH dont la valeur est élevée.
- Le pH augmente à nouveau lentement puis se stabilise.
- À l’équivalence du dosage d’un acide par la soude, la dérivée de la courbe pH = f (VB) donnant l’évolution du pH en fonction du volume de soude versé est à son maximum.
- Préparation d’une solution de soude.
- On dissout des pastilles d’hydroxyde de sodium.
- On obtient une solution aqueuse appelée soude.
- Équation de dissolution :
-
![]()
- Formule de la solution :
-
![]()
- Nom : Solution aqueuse d’hydroxyde de sodium.
La solution aqueuse d’acide chlorhydrique
- Préparation de la solution aqueuse de chlorure d’hydrogène appelée acide chlorhydrique :
- On dissout du chlorure d’hydrogène (gaz) dans l’eau.
- Équation de dissolution :
-
![]()
- Autre écriture :
-
![]()
- Formule de la solution aqueuse :
-
En première S :
![]()
-
En terminale S :
![]()
Caractéristiques de la réaction entre l’acide chlorhydrique et la soude :
- La réaction de dosage entre l’acide chlorhydrique et la soude :
H3O+ (aq)
+ HO– (aq) → 2 H2O
(ℓ)
-
![]()
- C’est la réaction inverse de l’autoprotolyse de l’eau.
- La constante d’équilibre de cette réaction est :
-
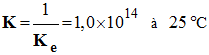
- cette réaction est quasi totale car K > 10 4.
- À l’équivalence, la solution obtenue est une solution de chlorure de sodium.
- Cette solution est neutre car elle contient des ions indifférents.
-
À
- À l’équivalence, la quantité de matière d’ions hydroxyde ajoutée est égale à la quantité de matière d’ions oxonium initialement présente.
Caractéristiques de la réaction de titrage acido-basique
- Une réaction de titrage acido-basique :
- Est quasi-totale
- Son taux d’avancement final τ ≈ 1
- La constante d’équilibre de la réaction K ≥ 104
- La réaction est unique et rapide.
- il y a équivalence lorsque les réactifs ont été mélangés dans les proportions stœchiométriques de la réaction.
- Le point d’équivalence est le point d’inflexion de la courbe pH = f (VB).
- Au point d’équivalence, on change de réactif limitant et la courbe change de concavité.
- Le point d’équivalence est caractérisé par ses coordonnées : pH E et VBE.
- Relation à l’équivalence :
- Un dosage consiste à déterminer la concentration d’une solution à l’aide d’une réaction avec une solution titrée.
-
Lorsque l’on dose un acide à l’aide d’une base, il
se produit la réaction suivante entre deux couples
acide / base : HA /
A–
et
BH+ /
B :
- Exemple :

- À l’équivalence, la quantité de matière d’acide apporté est égale à la quantité matière de base apportée :
-
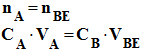
- Cette dernière relation permet de calculer la concentration inconnue CA à partir de la détermination graphique du volume VBE.
Détermination des coordonnées du point d’équivalence E
- elle permet par une méthode graphique de déterminer les coordonnées du point d'équivalence E.
- On trace deux tangentes à la courbe pH = f (VB), parallèles et situées de part et d'autre du point d'équivalence (point d'inflexion de la courbe) et suffisamment proche de l'équivalence.
- On trace ensuite la parallèle à ces deux tangentes, équidistantes de celles-ci.
- Son point d'intersection avec la courbe définit le point d'équivalence E.
- Méthode de la fonction dérivée.
- Pour repérer le point d’équivalence E, on peut tracer la courbe représentant le coefficient directeur a de la tangente à la courbe pH = f (VB).
- Le coefficient a est défini par la relation :
-
![]()
-
L’abscisse
VBE
du point
d’équivalence E est l’abscisse de l’extremum de la courbe
représentant
![]() en
fonction de VB.
en
fonction de VB.
- Exemple :
Détermination de VBE à l’aide d’un indicateur coloré.
- C’est le principe du dosage colorimétrique.
- Ce sont des indicateurs dont la teinte dépend du pH de la solution. Ils possèdent une zone de virage.
- Un indicateur coloré convient pour un dosage acido-basique si sa zone de virage contient le pH à l’équivalence.
- L’indicateur est convenablement choisi si l’ajout d’une seule goutte de solution titrante s’accompagne à la fois du passage par l’équivalence et d’un changement de couleur de l’indicateur.
- Exemple :
- Les indicateurs colorés sont constitués par des couples acide faible / base faible dont les espèces conjuguées ont des teintes différentes.
- Écriture symbolique :
-
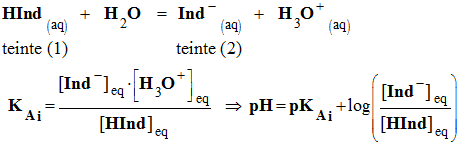
- On admet, de façon générale, que l'indicateur coloré prend sa teinte acide si :
-
![]()
- On admet, de façon générale, que l'indicateur prend sa teinte basique si :
-
![]()
-
Dans la zone de
pH,
comprise entre
![]() ,
l’indicateur coloré prend sa teinte sensible.
,
l’indicateur coloré prend sa teinte sensible.
- Les couleurs des teintes acide et basique se superposent. Cette zone est appelée zone de virage de l’indicateur coloré.
- Cas du B.B.T : Domaine de prédominance : zone de virage : 6,0 - 7,6.
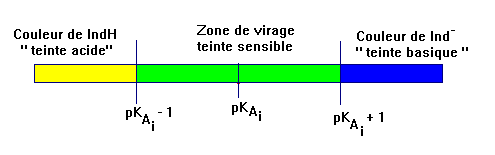
- Remarque : la zone de virage est inférieure à 2 unités pH car la teinte acide est jaune et la teinte basique est bleue.
- L’œil peut bien distinguer les deux couleurs.
- Il se peut que la zone de virage soit supérieure à 2 unités pH si l’œil a du mal à distinguer les deux couleurs.
Détermination de la valeur de la concentration inconnue :
- À l'équivalence, les réactifs ont été introduits dans les proportions stœchiométriques :
- nA = nB
- D'où :
- CA . VA = CB. VB
-
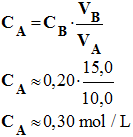
- La concentration est donnée avec la même précision que la donnée la moins précise. Ici, elle sera donnée avec deux chiffres significatifs.
Caractéristiques de la réaction entre l’acide éthanoïque et la soude.
- La réaction acido-basique fait intervenir les couples acide / base :
-
CH3COOH
/ CH3COO–,
pKA
= 4,8 et H2O / HO–,
pKe
= 14
- Il se produit la réaction :
![]()
- On peut calculer la constante l’équilibre K de cette réaction :
-

-
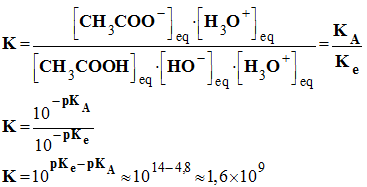
- cette réaction est quasi totale car K > 10 4.
- L’acide éthanoïque réagit quantitativement avec les ions hydroxyde.
- À l’équivalence, l’acide éthanoïque presque totalement transformé en ion éthanoate.
- On obtient une solution d’éthanoate de sodium.
- L’ion éthanoate est la base conjuguée de l’acide éthanoïque.
- À l’équivalence, la solution est basique : pH E > 7
Caractéristiques de la réaction entre l’ammoniac et l’acide chlorhydrique.
- Couples acide / base : NH4+ (aq) / NH3 (aq), pKA1 = 9,2 et H3O+ (aq) / H2O (ℓ), pKA2 = 0
- Équation de la réaction :
![]()
H3O+
(aq) + NH3 (aq) → NH4+
(aq) + H2O (ℓ)
-
Constante d’équilibre
K de la réaction :
-

-
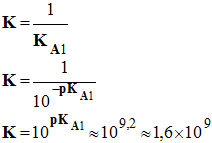
-
cette
réaction est quasi totale car K
> 104.
- à l’équivalence, on est en présence d’une solution aqueuse de chlorure d’ammonium.
- L’ion chlorure est un ion indifférent et l’ion ammonium est un acide : pHE < 7.
|
|





