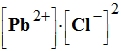|
QCM N° 04 |
Quotient de réaction : équilibre chimique |
|
|
|
QCM N° 04 Chimie : Quoitient de réaction : équilibre chimique Pour chaque question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
On donne la réaction suivante : =
I2
(aq) + 2 SO42–
(aq)
Le quotient de réaction, noté Qr, pour cette réaction dans un état donné du système s’écrit : |
|
|
|
A |
|
2 |
Lorsque l’eau est le solvant : |
Elle intervient dans l’écriture de l’expression du quotient de réaction |
Elle n’intervient pas dans l’écriture de l’expression du quotient de réaction |
Elle n’intervient pas dans l’écriture de l’expression du quotient de réaction que si elle n’intervient pas dans l’équation de la réaction |
B |
|
3 |
Le quotient de réaction : |
Est lié au sens d’écriture de l’équation de la réaction |
Est indépendant du sens d’écriture de l’équation de la réaction |
Ne dépend pas du sens d’écriture de l’équation de la réaction |
A |
|
4 |
On considère la réaction suivante : Cu (s) + 2 Ag+ (aq) =
Cu2+
(aq) + 2 Ag
(s) noté Qr, pour cette réaction dans un état donné du système s’écrit : |
|
|
|
C |
|
5 |
À un instant donné, le quotient de réaction : |
Ne dépend pas de l’avancement x de la réaction |
Dépend de l’avancement maximal xmax de la réaction |
Dépend de l’avancement x de la réaction |
C |
|
6 |
Quand pour une réaction xf < xmax, le quotient de réaction à l’état final : |
Est une constante appelée constante d’équilibre notée K. |
Dépend de la température du milieu réactionnel |
Dépend du taux d’avancement final de la réaction |
ABC |
|
7 |
On considère la réaction suivante : AH (aq) + H2O (ℓ) =
A–
(aq) + H3O+
(aq) À cet équilibre est associé une constante d’équilibre K telle que : |
|
|
|
A |
|
8 |
La constante d’équilibre K est liée au taux d’avancement final τ de la réaction par l’expression : |
|
|
|
B |
|
9 |
Pour une transformation donnée, à une température donnée, le tauxd’avancement final τ de la réaction : |
Ne dépend que la constante d’équilibre de la réaction |
Ne dépend que de l’état initial du système |
Dépend de la constante d’équilibre et de l’état initial du système |
C |
|
10 |
L’ion benzoate est une base dont la réaction avec l’eau n’est pas totale. On est en présence d’un équilibre chimique : C6H5COO– (aq) + H2O (ℓ) = C6H5COOH
(aq) + HO–
(aq) Le quotient de réaction, noté Qr, pour cette réaction dans un état donné du système s’écrit : |
|
|
|
C |
|
11 |
Toujours pour la réaction entre l’ion benzoate et l’eau. C6H5COO– (aq) + H2O (ℓ) = C6H5COOH
(aq) + HO–
(aq) À l’équilibre, le quotient de réaction vaut : |
Qr,eq = 0 |
Qr,eq = cte |
Qr,eq → ∞ |
B |
|
12 |
Si on ajoute des ions hydroxyde à une solution aqueuse d’ion benzoate, la constante d’équilibre K de la réaction entre l’ion benzoate et l’eau : |
K augmente |
K est inchangé |
K diminue |
B |
|
13 |
Si on dilue une solution aqueuse debenzoate de sodium, on déplace l’équilibre de la réaction entre l’ion benzoate et l’eau : |
Dans le sens direct |
Dans le sens indirect |
L’équilibre n’est pas modifié |
A |
|
14 |
Le chlorure de plomb PbCl2 (s) est un solide qui en solution aqueuse donne lieu à un équilibre chimique : PbCl2 (s) = Pb2+
(aq) + 2 Cl–
(aq) L’expression du quotient de réaction dans un état donné du système est donnée par l'expression : |
|
|
|
C |
|
15 |
Pour la réaction suivante,
Pb2+
(aq) + 2 Cl–
(aq) On donne Qr,eq = K La constante K ne dépend que de la température K (25 ° C) = 1,58 × 10– 5 et K (100 ° C) = 12,98 × 10– 5 Le chlorure de plomb est : |
Plus soluble à 25 ° C qu’à 100 ° C |
Moins soluble à 25 ° C qu’à 100 ° C |
On ne peut pas conclure |
B |
|
16 |
Le taux d’avancement final d’une réaction donnée : |
Dépend de l’état initial du système |
Est égal au rapport
|
Est indépendant de l’état initial du système |
AB |
|
17 |
Le quotient de réaction à l’équilibre, noté Qr,eq, |
Dépend de l’état initial du système |
Est aussi appelé constante d’équilibre de la réaction, noté K |
Est indépendant de l’état initial du système |
BC |
|
18 |
À même concentration initiale, c’est l’acide qui possède la plus grande constante d’équilibre K : |
Dont le taux d’avancement final est le plus grand |
Dont le taux d’avancement final est le plus petit |
Qui est le moins dissocié |
A |
|
19 |
Le taux d’avancement final d’une réaction chimique : |
Est d’autant plus grand que la concentration en soluté apporté est grande |
Est d’autant plus grand que la concentration en soluté apporté est faible |
Est d’autant plus faible que la concentration en soluté apporté est faible |
B |
|
20 |
Au cours d’une réaction chimique, le quotient de réaction Qr : |
Augmente obligatoirement |
Diminue obligatoirement |
Peut augmenter ou diminuer, cela dépend de l’état initial du système |
C |
|
|
- Système ne comportant que des espèces dissoutes.
-
Équation de la réaction :
![]()
- Le quotient de réaction, noté Qr, pour cette réaction dans un état donné du système s’écrit :
-

- La valeur du coefficient de réaction s’exprime par un nombre sans unité.
Cas d’une réaction où le solvant intervient.
- Exemple : réaction entre l’acide éthanoïque et l’eau.
-

- Par convention, l’eau, solvant, n’intervient pas dans l’écriture de l’expression de Qr (même s’il intervient dans l’équation de la réaction).
Quotient de la réaction et sens d’écriture de la réaction.
- L’expression du quotient de réaction Qr dépend du sens d’écriture de l’équation de la réaction.
- Les quotients des réactions inverses sont inverse l’un de l’autre.
Systèmes comportant des solides.
- Les espèces chimiques solides n’apparaissent pas dans l’expression du quotient des réactions.
-
Seules les
concentrations des
espèces dissoutes
sont à faire figurer
dans l'expression
d'un quotient de réaction Qr.
Quotient de réaction et avancement de la réaction.
- Le quotient de réaction Qr dépend de l’avancement x de la réaction.
Quotient de réaction dans l’état d’équilibre.
- Dans l’état d’équilibre d’un système, le quotient de réaction Qr,eq prend une valeur qui ne dépend pas de l’état initial.
- La valeur de Qr,eq est indépendante de la composition initiale.
- A chaque équation de réaction est associée une constante appelée constante d’équilibre notée K.
- Cette constante dépend de la température.
- Dans l’état d’équilibre : : Qr,eq = K.
- Si on considère la réaction chimique d’équation :
-
![]()
- Elle possède une constante d’équilibre donnée par l’expression :
-
 K
s’exprime sans unité.
K
s’exprime sans unité.
- Le taux d’avancement final d’une réaction dépend de sa constante d’équilibre.
- Exemple :
-
Équation de la réaction :
 .
.
- A cet équilibre est associé une constante l’équilibre K telle que :
-

- expression du taux d’avancement final de la réaction :
-

-
Conservation de la matière :
![]()
- Expression de K en fonction de τ et C.
-

- Le taux d’avancement final d’une réaction dépend de sa constante d’équilibre.
- A même concentration, c’est l’acide de plus grande constante d’équilibre dont le taux d’avancement final est le plus grand.
- Le taux d’avancement final d’une réaction dépend de l’état initial du système.
- Il est d’autant plus grand que la concentration en soluté apporté est faible.
|
|