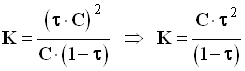|
Quotient de réaction. Cours. |
|
|
|
|
Programme 2012 : Programme 2020 : |
Exercices :
Pour aller plus loin :
|
Mots clés : Quotient de réaction ; constante d'équilibre ; taux d'avancement final ; Conductivité d'une solution ; La conductivité molaire ionique ; ... |
1)- Système ne comportant que des espèces dissoutes.
a)- Définition.
- Étudions la réaction suivante :
a . A (aq) + b . B (aq) = c . C (aq) + d . D (aq)
- Le quotient de réaction, noté Qr, pour cette réaction dans un état donné du système s’écrit :
-
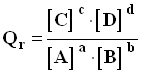
- La valeur du coefficient de réaction s’exprime par un nombre sans unité.
b)- Exemple :
- Écrire le quotient de réaction de la réaction suivante dans un état donné du système :
|
I2
(aq) +
2
S2O32–
(aq) = 2 I–
(aq) + S4O62–
(aq) |
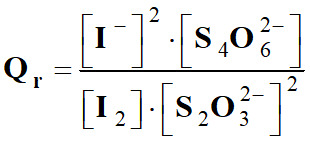
2)- Cas d’une réaction où le solvant intervient.
- Exemple : réaction entre l’acide éthanoïque et l’eau.
- 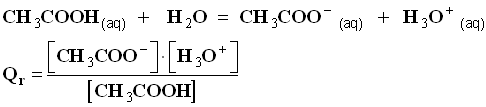
- Par convention, l’eau, solvant, n’intervient pas dans l’écriture de l’expression de Qr (même s’il intervient dans l’équation de la réaction).
3)- Quotient de la réaction et sens d’écriture de la réaction.
- Exemples :
- On étudie la réaction entre l’acide éthanoïque et l’ammoniac en solution aqueuse
- puis la réaction entre l’éthanoate de sodium et le chlorure d’ammonium en solution aqueuse.
- Écrire les équations des réactions et donner l’expression des quotients de réactions. Quelle remarque peut-on faire ?
- Réaction entre l’acide éthanoïque et l’ammoniac en lieu aqueux.
-
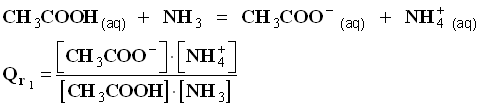
- Réaction entre l’éthanoate de sodium et le chlorure d’ammonium en milieu aqueux.
- 
- En conséquence :

- L’expression du quotient de réaction dépend du sens d’écriture de l’équation de la réaction.
- Les quotients des réactions inverses sont inverse l’un de l’autre.
4)- Systèmes comportant des solides.
- Les espèces chimiques solides n’apparaissent pas dans l’expression du quotient des réactions.
- Écrire le Qr de réaction de la réaction suivante :
-
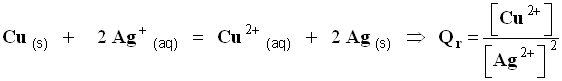
5)- Quotient de réaction et avancement de la réaction.
![]() Application :
Le quotient de réaction dépend-il de l’état du système ?
Application :
Le quotient de réaction dépend-il de l’état du système ?
- On étudie la réaction entre l’acide benzoïque et la solution aqueuse d’éthanoate de sodium.
- A l’instant initial, on mélange 10,0 mmol d’acide benzoïque et 20,0 mmol d’éthanoate de sodium.
- Le volume du milieu réactionnel est V = 100 mL.
- On donne :
|
CH3COOH (aq) / CH3COO –(aq) |
C6H5COOH (aq) / C6H5COO – (aq) |
|
Acide éthanoïque / ion éthanoate |
Acide benzoïque / ion benzoate |
- Écrire l’équation de la réaction.
- Dresser le tableau d’avancement de la réaction.
- Donner l’expression du quotient de cette réaction pour un état donné.
- Calculer la valeur du quotient de réaction pour l’avancement x = 2,0 mmol et x = 4,0 mmol. Conclure.
- Solution :
- Équation de la réaction :
C6H5COOH (aq) + CH3COO –(aq) = C6H5COO – (aq) + CH3COOH (aq)
- Tableau d’avancement de la réaction :
|
Équation |
C6H5COOH (aq) |
+ CH3COO–(aq) |
= |
C6H5COO– (aq) |
+ CH3COOH (aq) |
|
|
état |
x
(mmol) |
mmol |
mmol |
|
mmol |
mmol |
|
État initial
(mol) |
0 |
10,0 |
20,0 |
|
0 |
0 |
|
Au cours... |
x |
10,0 – x |
20,0 – x |
x |
x |
|
|
Avancement
final |
xf |
10,0
– xf |
20,0
– xf |
xf |
xf |
|
|
Avancement
maximal |
xmax |
10,0 – xmax = 0 |
20,0 – xmax = 0 |
|
xmax |
xmax |
- Expression de Qr.
-

- Pour faciliter l’étude suivante, on peut exprimer Qr en fonction de x avancement de la réaction.
- Sachant que :
- 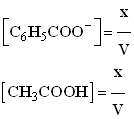
-
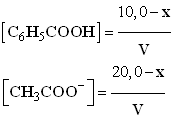
- 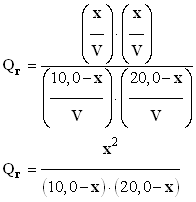
- Valeur de Qr2 :
-
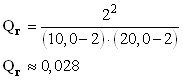
- Valeur de Qr4 :
-
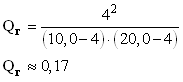
- Le quotient de réaction dépend de l’avancement x de la réaction.
- La question que l’on peut se poser : Que vaut le quotient de réaction lorsque l’état d’équilibre est atteint ?
- Sa détermination peut s’effectuer à partir d’une étude conductimétrique.
II- Détermination expérimentale d’un quotient de réaction.
![]()
(TP chimie N° 04) Détermination expérimentale du quotient de réaction
1)- Méthode.
- Il faut connaître les concentrations des différentes espèces chimiques lorsque l’équilibre chimique est atteint.
- Il faut mesurer la concentration d’une espèce chimique à l’équilibre à l’aide d’un capteur :
- Un pH-mètre (pour les réactions acido-basiques ou un conductimètre plus généralement.
- La réaction étudiée est celle entre l’acide méthanoïque (acide formique) et l’eau.
2)- Détermination du quotient de réaction à l’équilibre par conductimétrie.
(TP Chimie n° 04). Détermination expérimentale du quotient de réaction
- Méthode : elle est basée sur la comparaison des conductances de solutions d’acide chlorhydrique et d’acide méthanoïque de même concentration
III- Constante d’équilibre..![]()
1)- Conductivité et concentration. Rappels et compléments.
a)- La conductance : G c’est l’inverse de la résistance R :
-
![]()
- Pour une cellule conductimétrique, G dépend de la surface S des électrodes, de la distance ℓ entre les électrodes et de la nature de la solution.
- L’unité de conductance est le Siemens : S.
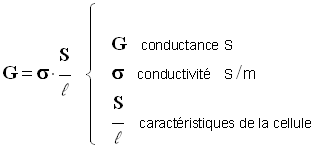
b)- Conductivité d’une solution.
- Relation entre la conductivité s (sigma)et la conductance :
- 
- On note :
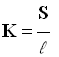 .
.
- Pour les solutions ioniques diluées d’un soluté unique, la conductivité de la solution est proportionnelle à la concentration en soluté apporté.
- Si C < 1,0 × 10 –2 mol / L, alors σ = Λ . C
- Cette constante, représente la conductivité molaire d’une solution ionique d’un soluté unique.
- On la note lambda majuscule : Λ Unité : S.m2.mol –1.
c)- Conductivité molaire ionique : λ.
- A chaque ion d’une solution ionique, on affecte une conductivité molaire ionique λ.
- Exemple : on considère une solution aqueuse de chlorure de sodium.
- La conductivité molaire de la solution est égale à la somme des conductivités molaires ioniques des ions présents dans la solution.
- Λ = λ (Na +) + λ (Cl -)
- La conductivité molaire ionique se rapporte à un ion donné.
- Elle dépend de la température, de la nature du solvant.
- Elle ne dépend pas de la concentration si C < 1,0 × 10 –2 mol / L.
- Expression de la conductivité d’une solution ionique quelconque contenant des ions monochargés différents.
- 
![]() Application :
Application :
- Calculer la conductivité d’une solution de chlorure de sodium de concentration C0 = 1,0 × 10 –3 mol / L.
- On donne : λ (Cl –) = 7,63 × 10 – 3 S. m 2 .mol – 1 et λ (Na +) = 5,01 × 10 – 3 S. m 2 .mol – 1
- Solution :
- Conductivité de la solution :
- Équation de la réaction :
|
H2O |
||
|
NaCl (s) → Na + (aq) + Cl –(aq) |
||
- Concentration en soluté apporté :
C0
= [
Cl
–
] = [
Na
+
]
- Avec : C0 = 1,0 × 10 –3 mol / L = 1,0 mol / m3.
- σ = λ (Na +) . [ Na + ] + λ (Cl –) . [ Cl – ]
- σ = (λ (Na +) + λ (Cl -)) . C0
- σ = (5,01 + 7,63) × 10 – 3 x 1,0
- σ ≈ 1,26 × 10 – 2 S. m– 1
- σ ≈ 1,3 × 10 – 2 S. m– 1
![]() Application :
Application :
- La conductivité d’une solution de nitrate de sodium est : s = 1,038 mS / cm.
- On donne : λ (NO3 –) = 7,14 mS. m 2 .mol – 1 et λ (Na +) = 5,01 mS. m 2 .mol – 1.
- En déduire la concentration en ions sodium de la solution.
- Solution :
- équation de la réaction :
|
H2O |
||
|
NaNO3 (s) → Na + (aq) + NO3 –(aq) |
||
- Dans cette solution :
[ NO3
–
] = [
Na
+
]
-

2)- Quotient de réaction dans l’état d’équilibre.
- Dans l’état d’équilibre d’un système, le quotient de réaction Qr,eq prend une valeur qui ne dépend pas de l’état initial.
- La valeur de Qr,eq est indépendante de la composition initiale.
![]() Application :
Application :
- Étude de la réaction entre l’acide éthanoïque et l’eau.
- On mesure la conductivité de deux solutions S1 et S2 d’acide éthanoïque de concentrations respectives C1 et C2.
- Les résultats sont donnés sous forme de tableau.
|
Acide éthanoïque |
S1 |
S2 |
|
Concentration C mol / L |
C1 = 5,0 × 10 –2 mol / L |
C2 = 5,0 × 10 –3 mol / L |
|
Conductivité s mS / cm |
σ 1 = 0,343 mS / cm |
σ 1= 0,107 mS / cm |
- On donne : λ (H3O +) = 35,0 mS. m 2 .mol – 1 et λ (CH3COO –) = 4,09 mS. m 2 .mol – 1.
- Déterminer la valeur de la concentration molaire en acide éthanoïque à l’équilibre : [CH3COOH] eq.
- En déduire la valeur du quotient de réaction à l’équilibre : Qr,eq .
- Calculer la valeur τ du taux d’avancement final de la réaction.
- Solution : Étude de la réaction entre l’acide éthanoïque et l’eau.
- Tableau d’avancement de la réaction :
|
Équation |
CH3COOH (aq) |
+ H2O (ℓ) |
= |
CH3COO - (aq) |
+ H3O + (aq) |
|
|
état |
Avancement
x (mol) |
|
|
|
|
|
|
État
initial (mol) |
0 |
napp |
excès |
|
0 |
0 |
|
Au
cours de la
transformation |
x |
napp – x |
excès |
x |
x |
|
|
Avancement
final |
xf |
napp
– xf |
excès |
xf |
xf
|
|
|
Avancement
maximal |
xmax |
napp – x
max
= 0 |
excès |
|
x max |
x max |
- Concentration molaire des ions présents à l’équilibre en fonction de la conductivité de la solution.
- σ1 = λ (H3O +) . [ H3O + ] eq + λ (CH3COO –) . [ CH3COO – ] eq
- D’après l’équation de la réaction : [ H3O + ] eq » [ CH3COO – ] eq, on néglige l’apport des ions oxonium dû à l’eau.
- 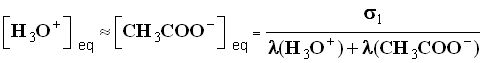
- Pour la solution S1, on trouve pour la concentration des ions oxonium et des ions éthanoate :
- Conservation de la matière : l’acide éthanoïque apporté, se trouve sous forme de molécules d’acide éthanoïque et d’ions éthanoate à l’équilibre.
- [ CH3COOH ]eq + [ CH3COO – ]eq = C 1 car il n'y a pas de variation de volume
- [ CH3COOH ]eq = C1 – [ CH3COO – ] eq
- [ CH3COOH ]eq = 5,0 × 10 – 2 – 8,87 × 10 – 4
- [ CH3COOH ]eq ≈ 4,9 × 10 – 2 mol / L
- Quotient de réaction à l’équilibre :
- Expression du quotient de réaction :
- 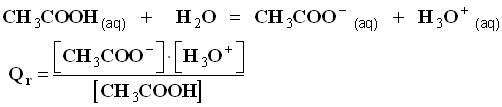
- Expression du quotient de réaction à l’équilibre :
- 
- Valeur pour la solution S1.
- 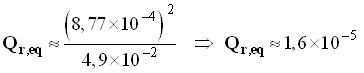
- Taux d’avancement final de la réaction :
-
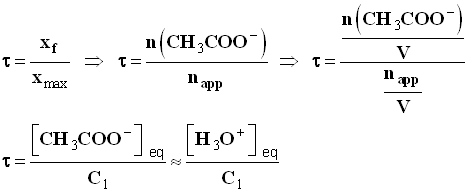
- Valeur du taux d’avancement final :
-
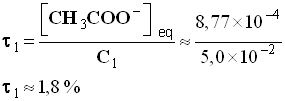
- Pour la solution S2, on trouve de la même manière :
- [ H 3 O + ] eq » [ CH3COO – ] eq ≈ 2,74 × 10 – 4 mol / L
- [ CH3COOH ] eq ≈ 4,7 × 10 – 3 mol / L
- Q r,eq ≈ 1,6 × 10 – 5
- 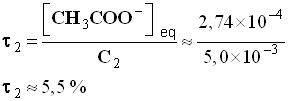 .
.
- Récapitulatif :
|
Acide éthanoïque |
S1 |
S2 |
|
Concentration C mol / L |
C1 = 5,0 × 10 – 2 mol / L |
C2 = 5,0 × 10 – 3 mol / L |
|
Taux d’avancement |
τ 1 = 1,8 % |
τ 2 = 5,5 % |
|
Qr,eq = K. |
1,6 × 10 – 5 |
1,6
× 10 –
5 |
|
Conclusion : Le taux d’avancement final de la réaction dépend de l’état initial du système Alors que le quotient de la réaction à l’équilibre est indépendant de l’état initial du système. |
- A chaque équation de réaction est associée une constante appelée constante d’équilibre notée K.
- Cette constante dépend de la température.
- Dans l’état d’équilibre : : Qr,eq = K.
- Si on considère la réaction chimique d’équation :
a . A (aq) + b . B (aq) = c . C (aq) + d . D (aq)
- Elle possède une constante d’équilibre donnée par l’expression :
-
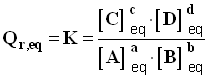 K
s’exprime sans unité.
K
s’exprime sans unité.
1)- Influence de la constante d’équilibre K sur le taux d’avancement final de la réaction.
![]() Application :
on donne le tableau suivant.
Application :
on donne le tableau suivant.
|
Concentration |
C = 5,0
× 10–2 mol / L |
Conductivité σ mS / cm |
K |
|
S1 |
Acide
éthanoïque |
σ 1 = 343 mS / cm |
1,60 × 10 –5 |
|
S2 |
Acide
méthanoïque |
σ 2 = 1129 mS / cm |
1,60 × 10 –4 |
- Conductivité molaire ionique :
- λ (H3O +) = 35,0 mS. m 2 .mol – 1 et λ (CH3COO –) = 4,09 mS. m 2 .mol – 1 et λ (HCOO –) = 5,46 mS. m 2 .mol – 1
- Calculer τ1 et t τ2 pour chaque réaction et conclure.
- Solution
- Réaction entre l’acide éthanoïque et l’eau. On a vu dans l’application précédente que :
-

- Pour calculer le taux d’avancement final, il faut tirer la valeur de la concentration en ion oxonium ou ion éthanoate de la valeur de la conductivité de la solution.
- σ 1 = λ (H3O +) . [ H3O + ] eq + λ (CH3COO –) . [ CH3COO – ] eq
- D’après l’équation de la réaction : [ H3O + ] eq ≈ [ CH3COO – ] eq , on néglige l’apport des ions oxonium dû à l’eau.
- 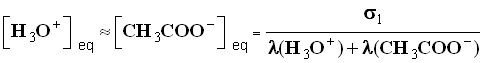
- Pour la solution S1, on trouve pour la concentration des ions oxonium et des ions éthanoate :
-

- Valeur du taux d’avancement final :
- 
- Réaction entre l’acide méthanoïque et l’eau.
- On a vu dans l’application précédente que :
-
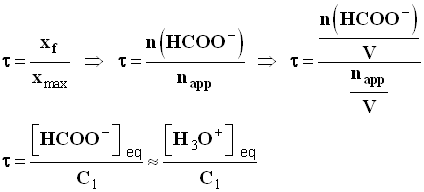
- Pour calculer le taux d’avancement final, il faut tirer la valeur de la concentration en ion oxonium ou ion éthanoate de la valeur de la conductivité de la solution.
- σ 1 = λ (H3O+) . [ H3O + ] eq + λ (HCOO –) . [ HCOO – ] eq
- D’après l’équation de la réaction : [ H3O+ ] eq ≈ [ HCOO - ] eq , on néglige l’apport des ions oxonium dû à l’eau.
- 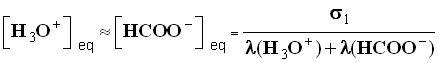
- Pour la solution S1, on trouve pour la concentration des ions oxonium et des ions éthanoate :
-
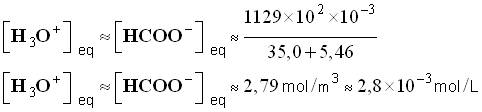
- Valeur du taux d’avancement final :
-
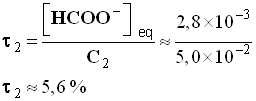
- Récapitulatif :
|
Concentration |
C = 5,0 × 10 –2 mol / L |
K |
Taux
d’avancement final |
|
S1 |
Acide
éthanoïque |
1,60 × 10 –5 |
1,8 % |
|
S2 |
Acide
méthanoïque |
1,60 × 10 –4 |
5,6 % |
|
Conclusion : Le taux d’avancement final d’une réaction dépend de sa constante d’équilibre. A même concentration, c’est l’acide de plus grande constante d’équilibre dont le taux d’avancement final est le plus grand. |
2)- Influence de l’état initial d’un système chimique sur le taux d’avancement final.
![]() Application :
Application :
- On mesure le pH à 25 °C de solutions aqueuses d’acide éthanoïque de différentes concentrations en soluté apporté.
- Calculer le taux d’avancement final pour chaque concentration et conclure.
- Tableau :
|
C mol / L |
1,0 × 10 –2 |
1,0 × 10 –3 |
1,0 × 10 –4 |
1,0 × 10 –5 |
|
pH |
3,41 |
3,93 |
4,49 |
5,16 |
|
τ % |
|
|
|
|
- Solution
- On utilise la relation approchée :
-
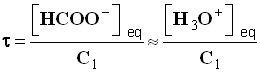
- Pour la première solution :
-
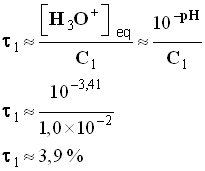
- Récapitulatif :
|
C mol / L |
1,0 × 10 –2 |
1,0 × 10 –3 |
1,0 × 10 –4 |
1,0 × 10 –5 |
|
pH |
3,41 |
3,93 |
4,49 |
5,16 |
|
τ % |
3,9 |
12 |
32 |
69 |
|
Conclusion : Le taux d’avancement final d’une réaction dépend de l’état initial du système. Il est d’autant plus grand que la concentration en soluté apporté est faible. |
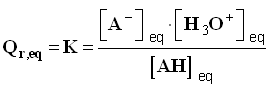
3)- Généralisation : réaction entre un acide AH et l’eau.
- Équation de la réaction :
AH (aq) + H2O (ℓ) = A – (aq) + H3O+(aq)
- A cet équilibre est associé une constante l’équilibre K telle que :
- 
- expression du taux d’avancement final de la réaction :
-
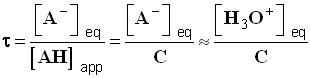 .
.
- Conservation de la matière : [ AH ] eq + [ A – ] eq = [ AH ] app = C
- Expression de K en fonction de τ et C.
- [ A– ] eq = [ H3O+ ] eq = τ . C
- [ AH ] eq + [ A – ] eq = [ AH ] app = C => [ AH ] eq = C – [ A – ] eq
- [ AH ] eq = C – τ . C
- [ AH ] eq = C . (1 – τ )
-