|
QCM N° 02 |
Vu au Collège Santé |
|
|
|
|
QCM N° 02
Vu au collège : La Santé.
Pour chaque question,
indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
On dissout du sucre dans l’eau, on obtient une solution non saturée. Cette solution peut être qualifiée de :
|
corps pur. |
mélange
homogène. |
mélange
hétérogène. |
B |
|
|
On dissout du sel dans l’eau, on obtient une solution d’eau salée non saturée. Le sel : |
est le
solvant. |
est le
soluté. |
a fondu. |
B |
|
|
Les constituants d’un mélange hétérogène : |
peuvent être séparés par
décantation. |
sont visibles
à l’œil nu. |
ne peuvent pas être
séparés. |
A et B |
|
|
Dans un corps pur constitué de molécules : |
toutes les molécules sont identiques. |
tous les atomes constituant une de ces molécules
sont identiques. |
toutes les molécules sont constituées
d’un seul atome. |
A |
|
|
Une
molécule : |
est toujours constituée d’atomes
identiques. |
peut être constituée d’atomes
identiques. |
est l’un des constituants
d’un atome. |
B |
|
|
La molécule d’eau, de formule
H2O,
est constituée : |
d’un atome d’hydrogène et de deux atomes
d’oxygène. |
de deux atomes d’hydrogène et d’un atome
d’oxygène |
de deux molécules d’hydrogène et d’une molécule
d’oxygène |
B |
|
|
Le pH
d’une solution acide est : |
supérieur à 7. |
égal à 7. |
inférieur à 7. |
C |
|
|
Le signal ci-dessous représente l’évolution au cours du temps d’une tension alternative périodique. |
quatre périodes sont visibles
à l’écran. |
la période de ce signal vaut 2,0
secondes. |
la période de ce signal
vaut 4 volts. |
A |
|
|
Une tension périodique a une fréquence de 40 Hz. Sa période T vaut : |
40 s. |
25 ms. |
0,025 s |
B et C |
|
|
Une tension périodique de période 2 s reprend les mêmes valeurs
toutes les : |
2 s. |
0,5 s. |
périodes. |
A et C |
|
|
3)-
Mélange hétérogène : Séparation : |
1)-
Dissolution :
a)-
Corps pur :
-
Un corps pur est composé d’un seul
constituant.
-
Un corps pur est constitué d’une seule espèce
chimique et peut être représenté par sa formule chimique.
-
Exemple : l’eau H2O
est un corps pur, le méthane CH4, le butane C4H10,
le dioxygène O2, ….
b)-
Un mélange :
-
Un mélange est constitué d’espèces chimiques
différentes.
-
Il ne peut pas être représenté par une
formule chimique.
-
Ainsi l’air est un mélange de dioxygène O2,
de diazote N2, l’argon Ar,…
c)-
Solution aqueuse :
-
Lorsqu’on dissout une espèce chimique dans
l’eau, on obtient une solution aqueuse.
-
L’espèce chimique dissoute est appelée le
soluté.
-
L’eau est le solvant.
-
L’eau peut dissoudre des :
- Solides (solides ioniques : chlorure de sodium, NaCl, chlorure de potassium, KCl, …),
- (Solides moléculaires : glucose, C6H11O6,
saccharose : C12H22O11)
-
Les liquides (Méthanol, CH3OH,
acide éthanoïque, CH3COOH, …)
-
Et des gaz (Dioxygène, O2,
dioxyde de carbone, CO2,…)
-
Exemple : Dissolution du sucre (Le
saccharose : C12H22O11)
dans l’eau : Préparation de la solution
-
On
obtient une solution sucrée qui est une solution aqueuse qui contient des
molécules de glucose parmi des molécules d’eau.
d)-
Mélange homogène :
-
Un mélange homogène est un mélange dont on ne
peut distinguer les différents constituants.
-
Pour séparer les constituants d’un mélange
homogène, il faut réaliser une distillation fractionnée.
e)-
Mélange hétérogène :
-
On réalise un mélange hétérogène lorsque l’on
mélange des espèces chimiques non miscibles.
-
L’eau et le cyclohexane constituent
un mélange hétérogène.
-
L’eau et le sable constituent un mélange
hétérogène.
- Pour séparer les constituants d’un mélange hétérogène, on peut réaliser :
- une filtration, une décantation, …
f)-
Solution saturée :
-
Une solution saturée est une solution qui ne
peut plus dissoudre de soluté.
-
Lorsque la limite de solubilité du soluté est
atteinte, le solvant ne peut plus dissoudre de soluté.
-
Exemple : Dans le cas de la dissolution d’un
soluté solide dans l’eau.
-
Lorsque la limite de solubilité du soluté est
atteinte, le solvant ne peut plus dissoudre de soluté.
- L’ajout de soluté à la solution saturée entraine la présence de deux phases :
- une phase aqueuse, la solution
saturée, et une phase solide, le soluté
-
On est en présence d’un mélange hétérogène.
2)-
L’eau salée :
-
On dissout du sel (Chlorure de sodium :
NaCl), cristal ionique dans
l’eau :
-
Le sel est le soluté et l’eau le solvant.
-
La dissolution d’un cristal ionique dans un
solvant polaire se déroule en 3 étapes :
-
La dissociation des ions du solide
-
La solvatation des ions : Les ions
s’entourent dans ce cas de molécules de solvant. On dit qu’ils sont solvatés
-
La dispersion des ions dans le solvant
-
Préparation de solutions ioniques.
-
Solution saturée :
-
On ne peut pas dissoudre plus
de 350 g de chlorure de sodium pour disposer d’un litre de solution à 25 °
C.
-
Au-delà de cette
masse, le chlorure de sodium ne se dissous plus.
-
On est en présence
d’une solution saturée dans laquelle on observe un dépôt de soluté au fond
du récipient.
►
Remarque :
-
Il ne faut pas confondre dissolution et
fusion.
-
Si l’on chauffe le chlorure de sodium, on
peut le faire fondre (θéb
= 801 ° C), c’est la fusion.
-
La fusion est le passage de l’état solide à
l’état liquide.
3)-
Mélange hétérogène : Séparation :
-
Pour séparer les constituants d’un mélange
hétérogène, on peut réaliser :
-
Une filtration,
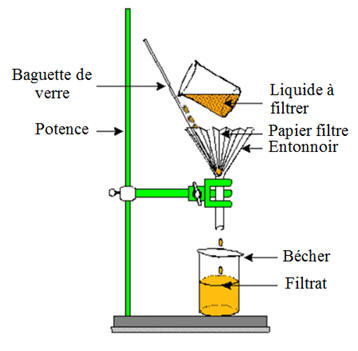
-
Une décantation
-
Exemple : eau bouseuse et cas des liquides
non miscibles.

4)-
Corps pur moléculaire :
-
Un corps pur est constitué de molécules
toutes identiques.
-
On distingue les corps purs simples et les
corps purs composés.
-
La molécule d’un corps pur simple est
constituée d’atomes tous identiques (He, O2, N2,…)
-
La molécule d’un corps pur composée est
constituée d’atomes différents (H2O, CO2,
NH3,..)
5)-
La molécule :
-
Une molécule est une entité chimique
électriquement neutre.
-
Elle est formée d’un nombre limité d’atomes
liés entre eux par des liaisons de covalence.
-
C’est le cas de la molécule d’eau qui
renferme deux atomes d’hydrogène et un atome d’oxygène.
-
La formule brute d’une molécule est
l’écriture la plus compacte décrivant la nature et le nombre d’atomes de
cette molécule.
-
Un atome est désigné par un nom et un symbole
chimique : l’atome d’hydrogène H, l’atome d’azote N,…
-
À chaque molécule est attribuée un nom et une
formule brute.
-
Dans la formule brute d’une molécule, les
symboles des éléments présents dans la molécule sont écrits côte à côte
avec, en indice, en bas à droite, le nombre d’atomes de chaque élément.
-
L’indice 1 n’est jamais spécifié.
-
La nature et le nombre des
atomes présents dans une molécule sont donnés par sa formule brute.
-
Exemples :
6)-
La molécule d’eau :
7)-
pH d’une solution.
►
Solution acide :
-
Elle contient plus d’ions hydrogène
H+ (aq) (ou ion oxonium H3O+)
que d’ions hydroxyde HO–
(aq).
-
Son pH est inférieur à 7 : pH <
7.
►
Solution neutre :
-
Elle contient autant d’ions hydrogène
H+ (aq) (ou ion oxonium H3O+)
que d’ions hydroxyde HO–
(aq).
-
Son pH est égal à 7 : pH = 7.
►
Solution basique :
-
Elle contient moins d’ions hydrogène
H+ (aq) (ou ion oxonium H3O+)
que d’ions hydroxyde HO–
(aq).
-
Son pH est supérieur à 7 : pH >
7.
8)-
Tension alternative périodique :
-
Le
terme alternatif signifie que la valeur de cette tension est alternativement
positive et négative.
-
Le
terme périodique signifie que la tension se reproduit identique à elle-même
au cours d’une durée appelée période, notée T.
-
La
période d’un T phénomène périodique est la plus courte durée
au bout de laquelle il se reproduit identique à lui-même.
-
Dans
le cas présent :
-
On
observe à l’écran 4 périodes.
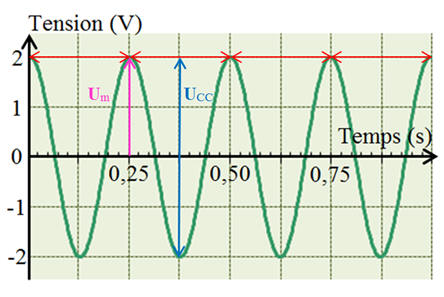
-
Valeur
de la période : T = 0,25 s
-
Amplitude de la tension Um = 2,0 V ; Umax
= 2,0 V et Umin = – 2,0 V
-
Tension de crête à crête : UCC = 4,0 V
9)-
Période et fréquence :
-
La période T d’un phénomène périodique
est la durée au bout de laquelle le phénomène se reproduit identique à
lui-même.
-
L’unité de période T est la seconde,
symbole s.
-
La fréquence f représente le nombre de
période par seconde. On écrit :
-
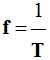
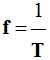
-
unité
de fréquence : Hertz : symbole Hz
-
Remarque : Pour obtenir la fréquence en Hz,
il faut pour cela exprimer la période en seconde s.
-
Exemple : si f = 40 Hz :
-
Valeur de la période :
-
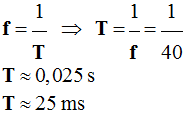
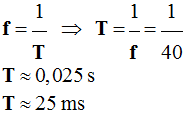
10)-
Tension périodique :
-
Une tension périodique est une tension qui
se reproduit identique à elle-même au
cours d’une durée appelée période, notée T.
- Si la période du phénomène T = 2,0 s, la tension périodique reprend les mêmes valeurs toutes les périodes, c’est-à-dire toutes les 2 secondes.
|
|





