|
Chim. N° 05 |
Les Solutions. Cours. |
|
|
Mots clés : Cours de chimie seconde Solutions Aqueuses, dissolution, Dissolution d'une espèce chimique moléculaire, solution de Dakin, concentration massique, titre massique, soluté, solvant, concentration molaire, quantité de matière, masse, volume, dilution , ... |
|
|
|
II- Concentration d’une solution. |
|
III- Préparation de solutions aqueuses. |
|
|
|
|
|
Exercices énoncé avec correction a)- Exercice 1 : Connaître les constituants d’une solution. b)- Exercice 3 : Calculer une concentration massique. c)- Exercice 5 : Calculer une concentration molaire. d)- Exercice 8 : Préparer une solution par dissolution. e)- Exercice 12 : Solution aqueuse pour décontamination de lentilles de contact. f)- Exercice 13 : à boire avec modération. g)- Exercice 15 : diluer un berlingot d’eau de Javel. h)- Exercice 17 : L’arnica : un médicament homéopathique. i)- Exercice 19 : Solution de Dakin. |
I- Dissolution d’une espèce chimique.
|
► Lorsqu’on dissout une espèce chimique dans un liquide on obtient une solution. ► L’espèce chimique dissoute est appelée le soluté. ► Le liquide dans lequel on dissout l’espèce chimique est appelé le solvant. ► Si le solvant utilisé est l’eau, on obtient une solution aqueuse. |
![]() Dissolution du sucre (le
glucose) dans l’eau C6H12O6
(s).
Dissolution du sucre (le
glucose) dans l’eau C6H12O6
(s).
- On obtient une solution sucrée qui est une solution aqueuse qui contient des molécules de glucose C6H12O6 (aq).
![]() Dissolution du permanganate
de potassium dans l’eau KMnO4 (s).
Dissolution du permanganate
de potassium dans l’eau KMnO4 (s).
- On obtient une solution aqueuse colorée (violette) qui contient des ions permanganate MnO4– (aq) et des ions potassium K+(aq).
![]() Dissolution de chlorure de
sodium dans l’eau NaCl (s).
Dissolution de chlorure de
sodium dans l’eau NaCl (s).

- On obtient une solution aqueuse salée qui contient des ions chlorure Cl– (aq) et des ions sodium Na+(aq).
|
► Remarque : dans l’eau, on peut dissoudre des solides, des liquides ou des gaz. |
|
Solides |
Liquide |
Gaz |
|
Glucose |
éthanol |
Dioxygène |
|
Chlorure de sodium |
|
Dioxyde de carbone |
- Certaines espèces chimiques sont insolubles dans l’eau comme le sable, l’huile.
- Une espèce chimique est insoluble dans l’eau si on la retrouve tel quelle en présence d’eau.
- Exemple : le diiode est très peu soluble dans l’eau.
- Le soluté n’est pas totalement dissous.
-
-
-
- Exemple : on ne peut pas dissoudre plus de 350 g de chlorure de sodium pour disposer d’un litre de solution à 25 ° C.
-
-
- Une solution est saturée lorsque le soluté introduit n’est pas totalement dissous.
- Une solution dans laquelle après agitation, tout le soluté solide introduit n’a pas disparu, est une solution saturée.
|
► Une solution est un liquide homogène contenant plusieurs constituants. ► L’espèce chimique mise en solution peut être constituée de : ► Molécules (solide moléculaire, liquide ou gaz) ► D’ions (solides ioniques). |
- Le soluté est ionique si la solution obtenue est formée d’ions parmi des molécules d’eau.
- C’est le cas de la solution aqueuse de sulfate de cuivre II.
- La solution contient des ions cuivre II, Cu2+ (aq) et des ions sulfate SO42– (aq).
- Lors de la réalisation de la solution avec le cristal ionique, le soluté réagit avec l’eau.
- Le soluté est moléculaire si la solution obtenue contient des molécules de soluté (soluté moléculaire) et des molécules d’eau.
- Lors de la réalisation de la solution, le soluté ne réagit pas avec l’eau.
-
- La solution de saccharose contient des molécules de saccharose et celle de diiode contient des molécules de diiode et bien sur des molécules de solvant : l’eau.
- Remarque : il se peut que le soluté moléculaire réagisse partiellement avec l’eau pour donner des ions.
- La solution aqueuse contient alors : des ions et des molécules de soluté n’ayant pas réagi.
- En conséquence :
|
► De manière générale, une solution aqueuse peut contenir ► des molécules ► des ions ► des molécules et des ions. |
- Pour séparer le soluté du solvant, il faut effectuer :
- Soit une distillation,
- Soit une évaporation.
II- Concentration d’une solution.
1)- Concentration massique ou teneur massique.
a)- Définition :
|
► La concentration massique d’une espèce chimique est la masse de cette espèce chimique dissoute dans un litre de solution |
- Relation :
|
Cas d’une espèce chimique A |
|
|
|
► t (A) concentration massique en soluté apporté en g / L ► m (A) masse de soluté apporté en g. ► V = V sol volume de la solution aqueuse obtenue en L. |
- Exemple : Étiquette d’une eau minérale.
|
Eau de source de montagne |
|
|
Analyse moyenne |
|
|
Calcium (Ca2+) |
64,5 mg / L |
|
Magnésium (Mg2+) |
3,5 mg / L |
|
Sodium (Na+ ) |
12,0 mg / L |
|
Potassium (K+ ) |
0,5 mg / L |
|
Fluorure (F
– ) |
< 0,1 mg / L |
|
Hydrogénocarbonate (HCO3– ) |
195,0 mg / L |
|
Chlorure (Cl– ) |
20,0 mg / L |
|
Sulfate (SO42 – ) |
6,0 mg / L |
|
Nitrate (NO3– ) |
2,5 mg / L |
|
Nitrite (NO2– ) |
< 0,05 mg / L |
|
Résidu sec à 180 ° C : 223,0 mg / L |
|
- L’étiquette donne la concentration massique des ions présents dans l’eau minérale.
a)- Définition.
|
► La concentration molaire d’une espèce chimique en solution est la quantité de matière de soluté présente dans un litre de solution. |
- Relation :
|
Cas d’une espèce chimique A |
|
|
|
► C (A) concentration molaire en soluté apporté en mol / L ► n (A) quantité de matière de soluté apporté en mol. ► V = V sol volume de la solution aqueuse obtenue en L. |
- Exemple :
- Les résultats d’analyses médicales indiquent les concentrations massiques et molaires des espèces chimiques dosées dans le sang.
3)- Relation entre quantité de matière, masse, volume et concentrations.
- On considère l’espèce chimique A de masse molaire M (A).
- On peut écrire les trois relations suivantes :
|
Cas d’une espèce chimique A |
|
|
|
► n (A) quantité de matière de l’espèce A en mol. ► m (A) masse de l’espèce A en g. ► M (A) masse molaire de l’espèce A en g / mol |
|
|
► C (A) concentration molaire en soluté apporté en mol / L ► n (A) quantité de matière de soluté apporté en mol.
►
V = Vsol
volume de la solution aqueuse obtenue en L. |
|
|
► t (A) concentration massique (titre massique) en soluté apporté en g / L ► m (A) masse de soluté apporté en g.
►
V = Vsol
volume de la solution aqueuse obtenue en L. |
- On en déduit la relation liant la concentration massique et la concentration molaire.
-
 ou
ou

- Cas d’une solution qui contient des molécules de soluté X.
- Il y a deux façons de noter la concentration :
- Soit CX ou [X] .
- Exemple :
- Pour une solution aqueuse de diiode de concentration 0,020 mol / L, on peut écrire :
- C (I2)
≈ 0,020 mol / L ou [
I2]
≈ 0,020 mol / L
- Car la solution aqueuse contient des molécules de diiode parmi des molécules d’eau.
- Cas d’une solution ionique.
- Exemple : une solution aqueuse de sulfate de cuivre II.
- C (CuSO4) ≈ 0,020 mol / L ou [Cu2+ ] ≈ 0,020 mol / L et [SO42 –] ≈ 0,020 mol / L
- Mais l’écriture : [CuSO4] ≈ 0,020 mol / L n’a pas de sens car la molécule de formule CuSO4 n’existe pas.
- Le cristal de sulfate de cuivre II de formule CuSO4 est un cristal ionique dans lequel il y a en proportion, un ion cuivre II pour un ion sulfate.
-
- La solution aqueuse obtenue contient autant d’ions cuivre II que d’ions sulfate.
5)- Calcul d’une concentration.
- Application 1 :
|
L’éthanol est un alcool que l’on retrouve dans les boissons alcoolisées. Sa formule brute est C2H6O. L’éthanol a une structure moléculaire. Donner sa formule développée et sa formule semi-développée. Dans une fiole jaugée de 100 mL, on introduit 0,020 mol d’éthanol, Puis on complète avec de l’eau distillée jusqu’au trait de jauge.
- Calculer la concentration en éthanol de la solution obtenue. |
- Réponse :
- Concentration en éthanol de la solution obtenue.
- 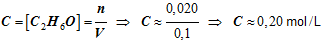
-
Application 2 :
|
on
dissout une masse m = La solution obtenue a un volume V = 100 mL. - Calculer la concentration molaire en glucose de la solution préparée.
- M (C6H12O6)
= |
- Réponse :
- Dans un premier temps, il faut déterminer la quantité de matière de glucose utilisé
- Quantité de matière de glucose utilisé :
- ![]() (1)
(1)
- Avec n quantité de matière en mol, m la masse du morceau de sucre en g et M la masse molaire du glucose en g / mol.
- Concentration en glucose de la solution :
- ![]() (2)
(2)
- en combinant (1) et (2) :
- 
III- Préparation de solutions aqueuses.
- La balance qui sert à peser les espèces chimiques solides et liquides.
- Les capsules et verres de montre qui peuvent contenir des solides (on les utilise lors des pesées)
- Les récipients comme les béchers et erlenmeyers qui peuvent contenir des espèces chimiques liquides ou des solutions aqueuses.
- La verrerie qui permet la mesure du volume d’une solution :
-
- Une pipette simple pour ajuster les volumes et une pissette d’eau distillée.
2)- Dissolution d’une espèce solide moléculaire.
- Application 3 :
|
On souhaite préparer un volume V = 100 mL d’une solution aqueuse de glucose de concentration : C = 0,100 mol / L à partir de glucose solide.
- M (C6 H12O6) = - Indiquer le matériel utilisé et donner le mode opératoire. - Déterminer la masse de glucose nécessaire à la préparation de la solution. |
- Réponse :
- Matériel utilisé : une balance pour peser le glucose, un verre de montre, un entonnoir, une fiole jaugée de 100 mL et de l’eau distillée.
![]() Mode opératoire :
Mode opératoire :
- On pèse la masse m de soluté au moyen d’une balance. .
-
- On introduit le solide dans une fiole jaugée de volume V = 100 mL en utilisant un entonnoir.
- On rince le récipient utilisé et l’entonnoir avec une pissette d’eau distillée.
- L’eau de rinçage doit couler dans la fiole jaugée.
- On remplit la fiole jaugée environ aux trois quarts avec de l’eau distillée et on agite pour accélérer la dissolution et homogénéiser la solution.
- On complète avec de l’eau distillée jusqu’au trait de jauge.
- On ajuste le niveau avec une pipette simple.
- On bouche et on agite pour homogénéiser.
- Masse de glucose nécessaire :
- On connaît la concentration C de la solution et son volume V.
- On peut en déduire la quantité de matière nécessaire : n = C . V (1)
- Masse de glucose nécessaire : m = n . M (2)
- En combinant (1) et (2) : m = C . V . M
- Application numérique :
- m ≈ 0,100 x 0,100 x 180
- m ≈ 1,80 g
- Schématisation des différentes étapes :
|
Protocole |
|
|
|
|
|
Fiole jaugée de 100 mL |
|
|
|
|
|
|
|
|
|
|
3)- Dilution d’une solution aqueuse.
- Diluer une solution, c’est en ajoutant du solvant, préparer une nouvelle solution moins concentrée que la solution initiale.
- Lors d’une dilution, la concentration molaire du soluté diminue, mais sa quantité de matière ne change pas.
- On dit qu’au cours d’une dilution, la quantité de matière de soluté se conserve.
- La solution de départ est appelée la solution mère et la solution diluée est appelée la solution fille.
- 
- si A représente l’espèce présente dans la solution.
-
-
- la quantité de matière de soluté présente dans la solution mère : n (A) = C1 . V1 (1)
- la quantité de matière de soluté présente dans la solution fille : n (A) = C2 . V2 (2)
- Conséquence :
![]()
- Avec obligatoirement V1 < V2 .
- Le facteur de dilution
![]() , F est toujours supérieur à 1.
, F est toujours supérieur à 1.
b)- Réalisation pratique d’une dilution.
- La dilution nécessite d’effectuer des mesures précises de volumes.
- On utilise pour ces opérations le matériel suivant :
- Burette graduée, ou pipette graduée ou jaugée, fiole jaugée.
- Application 4 :
|
On désire préparer une un volume V1 = 200 mL d’une solution de diiode de concentration C1 = 1,0 x 10‑3 mol / L à partir d’une solution mère de diiode de concentration C = 2,0 x 10-2 mol / L. - Déterminer le volume de solution mère nécessaire à la préparation de la solution. - Indiquer le matériel utilisé et donner le mode opératoire. |
- Réponse :
- Au cours de la dilution, il y a conservation de la quantité de matière de soluté :
- Si on note n la quantité de matière de soluté utilisé :
- 
- Matériel :
- Récipient : bécher ou erlenmeyer.
- Matériel permettant la mesure précise de volumes :
- Une pipette jaugée de 10 mL munie de sa propipette.
- Une fiole jaugée de 200 mL
- Pipette simple pour ajuster le volume.
- Solutions : solution mère et pissette d’eau distillée.
![]() Mode opératoire :
Mode opératoire :
- On verse un peu de solution mère dans un bécher (on ne pipette jamais dans le récipient qui contient la solution mère).
- On prélève le volume V = 10 mL à l’aide d’une pipette jaugée munie de sa propipette.
- On verse le volume V = 10 mL dans une fiole jaugée de 200 mL.
- On remplit la fiole jaugée environ aux trois quarts avec de l’eau distillée. On mélange.
- On complète avec de l’eau distillée jusqu’au trait de jauge.
- On ajuste le niveau avec une pipette simple.
- On bouche et on agite pour homogénéiser.
- Schématisation des différentes étapes :
|
Verser suffisamment de solution Mère dans un bécher |
Deuxième étape : On prélève le volume nécessaire de solution Mère à l’aide d’une pipette jaugée munie de sa propipette |
Troisième étape : On verse le volume nécessaire de solution dans la fiole jaugée de volume approprié.. |
|
On ne pipette jamais directement dans le flacon qui contient la solution Mère |
|
|
|
Quatrième étape : On ajoute de l’eau distillée et on agite, mélanger et homogénéiser |
Cinquième étape : On complète avec une pissette d’eau distillée jusqu’au trait de jauge. |
Sixième étape : on agite pour homogénéiser. La solution est prête. |
|
|
|
|
1)- QCM : Pour chaque question, indiquer la (ou les) bonne(s) réponse(s).
|
|
2)- Exercices : Exercices énoncé avec correction
a)- Exercice 1 : Connaître les constituants d’une solution.
b)- Exercice 3 : Calculer une concentration massique.
c)- Exercice 5 : Calculer une concentration molaire.
d)- Exercice 8 : Préparer une solution par dissolution.
e)- Exercice 12 : Solution aqueuse pour décontamination de lentilles de contact.
f)- Exercice 13 : à boire avec modération.
g)- Exercice 15 : diluer un berlingot d’eau de Javel.
h)- Exercice 17 : L’arnica : un médicament homéopathique.
i)- Exercice 19 : Solution de Dakin.
|
|