|
Force des acides et des bases |
|
|
|
|
|
|
QCM N°
08
Force des acides
et des bases.
La réaction d’un
acide ou d’une base avec l’eau.
La constante
d’acidité d’un couple acide-base.
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
La constante Ke : |
Vaut 14
à 25 ° C |
Est le
produit ionique
de l’eau |
Est égale à
[H3O+]éq
. [HO –]éq
|
BC |
|
2 |
À 25 ° C, la concentration en ions hydroxyde d’une
solution aqueuse est :
[HO –]éq = 1,0 ×10–6
mol . L–1
La solution :
|
A une concentration en ion
H3O+
(aq)
égale à 1,0 × 10–8
mol . L–1 |
A un pH =
6,0 |
Est acide |
A |
|
3 |
L’acide
hypochloreux
HCℓO
(aq) est un acide
faible dans
l’eau. |
Le taux d’avancement final de la
transformation est forcément
nul. |
Le pH de
la solution d’acide
hypochloreux de concentration C en acide
apporté
est
pH
= – log C. |
Le taux
d’avancement
final de la
transformation
est tel que :
τ
< 1 |
C |
|
4 |
L’ion méthanolate CH3O– est une base forte dans l’eau. À 25 ° C, le pH d’une solution aqueuse de concentration en ions
méthanoate
apportés C = 1,0 × 10–3 mol . L–1
est : |
pH
= 3,0 |
pH=
11,0 |
pH
= 13,0 |
B |
|
5 |
La constante
d’acidité
associée à
l’équation
ci-dessous
s’écrit : HNO2 (aq) + H2O (ℓ)
H3O+ (aq) + NO2–
(aq) |
|
|
|
C |
|
6 |
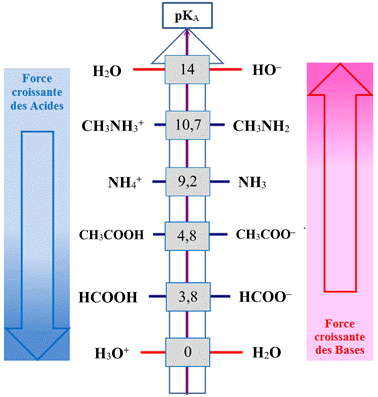
Les couples
NH4+ (aq) / NH3 (aq) et
CH3NH3+(aq)/CH3NH2(aq)
ont pour pKA
respectifs
9,2 et 10,7,
donc : |
CH3NH2 (aq) est une base
plus
forte
que NH3
(aq)
dans l’eau
|
CH3NH3+ (aq) est un acide
plus
fort
que NH4+
(aq)
dans l’eau
|
NH4+
(aq)
est un acide plus fort que
CH3NH3+
(aq)
dans l’eau |
AC |
|
7 |
Pour un couple
acide-base AH (aq) / A– (aq), la relation liant le pH et
le pKA s’écrit : |
|
|
|
B |
|
8 |
L’ammoniac est la base du couple
NH4+
(aq) / NH3 (aq) de pKA = 9,2. Dans une solution aqueuse
d’ammoniac, si : |
Aucune espèce
ne prédomine,
alors pH =
7,0. |
NH3 (aq)
prédomine
sur NH4+
(aq),
alors pH =
8,0. |
Aucune des deux espèces
ne
prédomine,
alors pH =
9,2 |
C |
|
9 |
L’hélianthine est un indicateur coloré acido-basique prenant différentes teintes selon
le
pH
de la solution.
Le pH à
l’équivalence d’un titrage d’une base par un
acide est pHE
= 5,8.
L’hélianthine :
|
Est un
indicateur
coloré adapté
à ce titrage. |
prend sa
teinte sensible
après
l’équivalence
du titrage |
prend sa
teinte sensible
avant
l’équivalence
du titrage |
B |
|
10 |
Au produit
ionique de l'eau, on associe une autre grandeur nommée pKe. Cette grandeur est définie
par
la relation |
Ke
= – log (pKe) |
Ke
= 10–pKe |
Ke
= – pKe |
B |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
Couples
acide / base.
►
La notation
AH /
A–
|
AH
(aq) |
|
A–
(aq) |
+ |
H+ |
|
Acide |
|
Base |
|
ion
hydrogène |
|
AH
(aq) |
→ |
A–
(aq) |
+ |
H+ |
|
Ou bien |
||||
|
A–
(aq) + H+
|
→ |
AH
(aq) |
|
|
Réaction
acido-basique.
A1H
+
A2–
![]() A1–
+
A2H
A1–
+
A2H
ou
A1H
+
A2–
→
A1–
+
A2H
Produit ionique de l’eau :
|
Sens
direct : Autoprotolyse de l’eau |
||
|
H2O
(ℓ) +
H2O (ℓ) |
|
H3O+ (aq) +
HO–
(aq) |
|
Sens inverse |
||
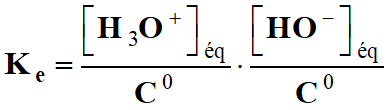 ou plus
simlement :
ou plus
simlement : Acide faible dans l’eau.
|
AH
(aq)
+ H2O (ℓ) |
|
H3O+ (aq) +
A–
(aq) |
Base faible dans l’eau.
|
A–
(aq) +
H2O (ℓ) |
|
HO–
(aq) +
AH
(aq) |
Acide fort dans l’eau.
|
AH
(aq)
+ H2O (ℓ) |
→ |
H3O+ (aq) +
A–
(aq) |
|
pH
= – log C |
Valable pour
10–2 mol . L–1 ≤
C ≤ 10–6 mol .
L–1 |
Base forte dans l’eau.
|
A–
(aq) +
H2O (ℓ) |
→ |
HO– (aq) +
AH
(aq) |
|
pH
= 14 + log C |
Valable pour
10–2 mol . L–1 ≤
C ≤ 10–6 mol .
L–1 |
Constante
d’acidité KA
et pKA.
|
AH (aq)
+ H2O (ℓ) |
|
H3O+
(aq) +
A–
(aq) |
|
|
|
|
KA |
Constante
d’acidité (sans unité) |
|
[AH]éq |
Concentration de
l’acide à l’équilibre (mol . L–1) |
|
[A–]éq
|
Concentration de
la base conjuguée (mol . L–1) |
|
[H3O+]éq |
Concentration en
ions oxonium (mol . L–1) |
|
C0 |
Concentration
standard : C0 =
1,0 mol . L–1 |
Effet nivelant de l’eau.
H3O+ + OH– ![]() 2 H2O
pKe = 14 à 25 ° C
2 H2O
pKe = 14 à 25 ° C
Force comparées des acides et des bases :
Domaine de prédominance :
|
AH (aq) |
+ |
H2O
(ℓ) |
|
A–
(aq) |
+ |
H3O+
(aq) |
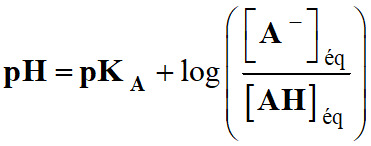
Diagramme de distribution et de prédominance.
►
Diagramme de
distribution :
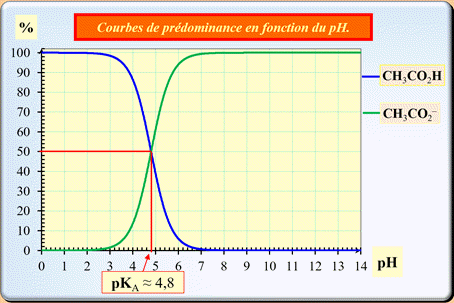
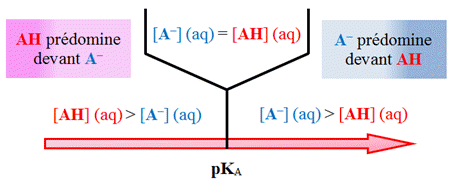
►
Diagramme de
prédominance :
Indicateur coloré acido-basique.
|
Hind
(aq) |
+ |
H2O
(ℓ) |
|
Ind–
(aq) |
+ |
H3O+
(aq) |
|
Teinte (1) |
|
|
|
Teinte (2) |
|
|
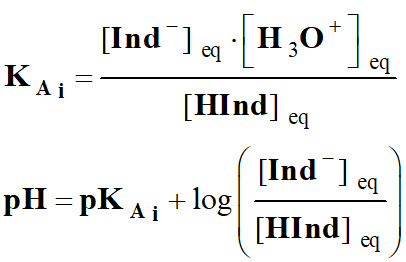
|
pKAi
– 1
pKAi
pKAi
+ 1
|
||
|
Couleur de InH….. |
Zone
de Virage
.. |
Couleur
de In–… |
|
Teinte acide |
Teinte sensible |
Teinte basique |
|
|
3,1
4,4 |
||
|
Hélianthine |
rouge |
Zone de
Virage
orange |
Jaune |
|
|
6,0
7,6 |
||
|
B.B.T |
Jaune….. |
Zone de Virage..
vert |
Bleu……
|
|
|
8,2
10 |
||
|
Phénolphtaléine |
Incolore |
Zone de virage
Rose très pâle |
Rose |
Solution tampon
et contrôle du pH.
Cas des acides
α-aminés.
|
|
|
|
|
Acide α-aminé |
|
Amphion ou
zwitterion |
|
H3N+
– CHR – COO–
(aq) |
|
H2N – CHR – COO– (aq) |
+ |
H+ |
|
Amphion |
|
Anion |
|
|
|
H3N+ – CHR – COOH
(aq) |
|
H3N+ – CHR – COO–
(aq) |
+ |
H+ |
|
Cation |
|
Amphion |
|
|
Échelle des
pKA.
|
|