|
Méthodes d'analyse physique |
|
|
|
|
|
|
QCM N°
02
Méthodes
d’analyse physique
Les dosages par
étalonnage
La détermination
d’une quantité de gaz
La spectroscopie
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Un dosage par
étalonnage : |
Est réalisé
en utilisant
des solutions
étalons. |
Met en
jeu une réaction
chimique |
Permet de
déterminer la
concentration
d’une espèce
chimique |
AC |
|
2 |
La droite
d’étalonnage
d’un dosage
spectrophotométrique : |
Peut être
exploitée avec
la loi de
Beer-Lambert |
A un
coefficient
directeur
sans unité |
Est la droite
représentative
de A =
f (C) |
AC |
|
3 |
L’absorbance
d’une
solution colorée
diluée est :
|
Indépendante de
l’espèce chimique
absorbante |
Proportionnelle
à la
concentration
en espèce
absorbante |
Est un nombre
sens
unité |
BC |
|
4 |
Le graphe
ci-dessous
a été obtenu lors
d’un dosage par
conductimétrie. Ce graphe :
|
Traduit la
relation de
proportionnalité
entre σ et
C |
Traduit la
loi de
Beer-Lambert |
Est une
courbe
d’étalonnage |
AC |
|
5 |
La
conductivité d’une
solution C
en soluté est
σ
= 1,0 mS . cm–1. En
exploitant le
graphe ci-dessus, on
détermine que : |
C
= 4,0 mmol . L–1 |
L’équation de
la courbe est
σ
= 0,25 × C |
L’équation de la
courbe est
σ
= 4,0 × C |
AB |
|
6 |
L’équation d’état
du gaz parfait :
|
S’écrit
P . V
= n . R . T |
Est valable
quelle que
soit la
pression
du gaz |
Permet de
calculer une
quantité de matière
de gaz |
AC |
|
7 |
Lors de
l’utilisation de
l’équation d’état
du
gaz parfait :
|
La température
doit être
exprimée
en ° C |
Le volume
doit être
exprimé
en L |
La pression
doit être
exprimée
en Pa |
C |
|
8 |
Pour calculer une
quantité de
matière n
de gaz, on peut
utiliser
la relation :
|
n
= C × Vsolution |
|
|
BC |
|
9 |
Le spectre UV-visible
d’une molécule
peut
permettre :
|
De déterminer
les groupes
caractéristiques
qu’elle contient |
D’identifier sa chaîne
carbonée |
De
l’identifier |
C |
|
10 |
Les bandes
d’absorption
du spectre IR
d’une
molécule de
nombres
d’onde supérieurs
à 1500 cm–1
peuvent
permettre :
|
De déterminer
les groupes
caractéristiques
qu’elle contient |
D’identifier sa chaîne
carbonée |
De
l’identifier |
A |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
Les dosages par étalonnage :
|
Réaliser un dosage par étalonnage consiste à déterminer
la concentration
d’une espèce en solution en comparant
une grandeur
physique, caractéristique de la solution, à
la même grandeur
physique mesurée pour des solutions étalons. |
Dosage spectrophotométrique.
Loi de
Beer-Lambert.
|
L’absorbance
d’une solution diluée contenant une espèce colorée
est
proportionnelle à la concentration (effective)
C de cette espèce
et à l’épaisseur
ℓ (cm) de la solution traversée par le faisceau lumineux. |
|
A (λ)
= ε (λ) .
ℓ .
C |
|
A :
absorbance : grandeur sans unité |
|
ℓ :
largeur de la cuve (épaisseur de la solution traversée) (cm) |
|
ε
(λ) : coefficient d’extinction molaire (mol– 1. L. cm–
1) |
|
C :
concentration de l’espèce absorbante (mol . L– 1) |
Dosage conductimétrique :
- La conductance
G d’une solution :
|
|
G
est la conductance en siemens S |
|
S :
surface des
électrodes en m2. |
|
|
ℓ :
distance entre les électrodes en m. |
|
|
σ :
conductivité de
la solution en S . m– 1 |
Conductivité d’une solution ionique :
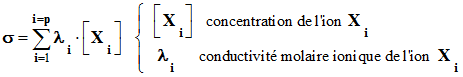
Énoncé de la loi
de Kohlrausch :
|
La conductivité
σ
d’une solution diluée d’une espèce ionique
dissoute est
proportionnelle à sa concentration molaire
C en
soluté apporté : |
|
σ =
k .
C |
|
σ
= k . C |
C ;
concentration en mol . L– 1
|
|
k :
coefficient de
proportionnalité en S . L .
m– 1. mol– 1
|
|
|
σ :
conductivité de
la solution en S . m– 1 |
Équation d’état du gaz parfait :
|
P
. V
= n . R . T |
|
|
P |
Pression en pascal (Pa) |
|
V |
Volume en mètre cube (m3) |
|
n |
Quantité de matière en mole (mol) |
|
R |
Constant des gaz parfaits : R =
8,314 Pa . m3 .mol–1 . K–1 |
|
T |
Température absolue en kelvin (K) |
Quantité de matière d’un gaz :
|
|
|
|
P |
Pression en
pascal (Pa) |
|
V |
Volume en mètre
cube (m3) |
|
n |
Quantité de
matière en mole (mol) |
|
R |
Constant des gaz
parfaits : R = 8,314 Pa . m3 .mol–1 . K–1 |
|
T |
Température
absolue en kelvin (K) |
Le volume molaire :
|
Le volume molaire d’un gaz parfait est le
volume occupé
par une mole de
ce gaz |
|
|
|
|
|
P |
Pression en
pascal (Pa) |
|
Vm |
Volume en mètre
cube par mole (m3. mol–1) |
|
R |
Constant des gaz
parfaits : R = 8,314 Pa . m3 .mol–1 . K–1 |
|
T |
Température
absolue en kelvin (K) |
Groupes caractéristiques et fonctions.
|
Groupe caractéristique |
Famille
de composés |
Formule générale |
|
– OH Hydroxyle |
Alcool |
R – OH |
|
Carbonyle |
aldéhyde |
|
|
Cétone |
|
|
|
carboxyle |
Acide
carboxylique |
|
|
groupe ester |
Ester |
|
|
|
Alcène |
|
|
|
Amine
(Primaire) |
|
|
|
Amide |
|
Spectroscopie UV-visible.
Spectroscopie infrarouge :
Le nombre d’onde
compris entre 1500 et 4000 cm–1.
Le nombre d’onde
compris entre 400 et 1500 cm–1.
Utilité du spectre infrarouge :
Bandes caractéristiques :
|
Liaison |
σ (cm–1) |
Bande |
|
–O – H
Alcool |
3200 – 3400 |
Bande forte et
large |
|
–O – H
Acide
carboxylique |
2600 – 3200 |
Bande forte et
large |
|
C = O
Aldéhyde
Cétone
Acide
carboxylique |
1700 – 1760 |
Bande forte et
fine |
|
C = O
Ester |
1700 - 1740 |
Bande forte et
fine |
|
C = C
Alcène |
1625 - 1685 |
Bande moyenne |
|
N – H
Amine |
3100 - 3500 |
Bande moyenne |
|
|