|
Tableau d'anvancement |
|
|
|
|
|
|
QCM N° 03
Le tableau
d’avancement.
Les
transformations totales et non totales.
Mélange
stœchiométrique.
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
L’avancement
x : |
S’exprime en mol. |
N’a pas d’unité. |
Augmente
au cours de
la réaction. |
AC |
|
2 |
Dans le
tableau d’avancement,
on indique : |
Les masses
des espèces
chimiques. |
Les quantités
de matières
des espèces
chimiques |
Les volumes
des espèces
chimiques. |
B |
|
3 |
Au cours de
l’évolution
d’un système
chimique : |
Les quantités
des réactifs
augmentent |
Les quantités
des produits
augmentent |
Les quantités
des réactifs
diminuent |
BC |
|
4 |
Soit la
réaction d’équation : Aℓ3+
(aq) + 3 HO– (aq) → Aℓ(OH)3
(s) Au cours de la
transformation : |
La quantité
restante d’ions
hydroxyde est
n0
(HO–) – 3 x |
La quantité
restante d’ions
aluminium est
n0
(Aℓ3+) + x |
La quantité
d’hydroxyde
d’aluminium
Aℓ(OH)3
formé
est x. |
AC |
|
5 |
Si, dans l’état final de la réaction de la question 4,
correspondant
à une transformation
totale, les quantités finales des réactifs exprimés en mol sont : n (Aℓ3+) = 6,0 – xmax
et
n (HO–) = 9,0 – 3 xmax Alors : |
xmax
= 6,0 mol |
xmax
= 3,0 mol |
L’ion Aℓ3+
est le réactif
limitant. |
B |
|
6 |
Dans un autre
état final de la réaction de la question 4, il s’est formé 2,0 mol de Aℓ(OH)3
(s). Alors : |
xmax
= 0,50 mol |
xmax
= 1,0 mol |
xmax
= 2,0 mol |
C |
|
7 |
Si une transformation n’est pas totale, alors l’avancement final xf de la réaction associée est : |
Supérieur
à xmax
|
Égal
à xmax |
Inférieur
à xmax |
C |
|
8 |
Lors d’une
transformation
totale associée à un
mélange
stœchiométrique des réactifs :
|
Les réactifs
sont entièrement
consommés |
L’état final ne
contient que les
produits de la
réaction et
éventuellement
les espèces
spectatrices |
Les quantités
des réactifs
sont nulles
dans l’état
final |
ABC |
|
9 |
Dans l’état
final d’une transformation
totale pour laquelle
les quantités des
deux réactifs,
exprimées en mol, sont : nréactif1
= 6,0 –2 xmax nréactif2 =12,0 –4 xmax : |
Le mélange
initial des
réactifs est
stœchiométrique. |
Le mélange
initial des
réactifs
n’est pas
stœchiométrique. |
Les valeurs
de xmax
sont égales. |
AC |
|
10 |
La réaction
d’équation : 2 H2
(g) + O2 (g) → 2 H2O
(ℓ) est associée à
une
transformation totale. Un mélange de
dihydrogène
H2 et de dioxygène
O2 est
stœchiométrique si : |
|
2 n0
(H2) = n0 (O2) |
|
C |
QCM réalisé avec le logiciel
Questy
Pour s’auto-évaluer.
Avancement d’une réaction chimique :
-
L’avancement
x d’une
transformation chimique est une grandeur exprimée en mole qui permet de décrire
l’état du système au cours de la réaction chimique.
-
Il permet d’exprimer
les quantités de matière de réactifs et de produits présents dans le système
chimique à chaque instant, de l’état initial à l’état final.
-
L’avancement
x est une quantité
de matière. Elle s’exprime en mol.
-
Dans l’état initial,
x = 0 mol
-
au
cours de la transformation,
0
≤ x
≤ xf
-
À l’état final :
x =
xf.
-
L’avancement
x d’une
réaction chimique augmente au cours d’une réaction chimique.
Tableau d’avancement :
-
Il permet de
synthétiser tous les résultats.
-
Il décrit l’évolution
des quantités de matière du système de l’état initial à l’état final en fonction
de l’avancement x.
-
Un exemple de tableau
d’avancement :
-
La
grandeur xf
représente l’avancement final.
|
Équation |
I2 (aq)
|
+
2 S2O32–
(aq) |
→ |
2
I– (aq) |
+
S4O62– (aq) |
|
|
État du
système |
Avancement |
n (I2)
|
n (S2O32–) |
|
n (I–) |
n
(S4O62–) |
|
État initial
(mmol) |
x =
0 |
n1
= 0,10 |
n2
= 0,40 |
0 |
0 |
|
|
État
intermédiaire |
0 ≤ x ≤ xf |
0,10 – x |
0,40 – 2 x |
2
x |
x |
|
|
État final
(mmol) |
x = xf |
0,10 – xf |
0,40 – 2
xf |
|
2
xf |
xf |
|
Équation |
Aℓ3+
(aq) |
+
3
HO– (aq) |
→ |
Aℓ(OH)3
(s) |
|
|
État du
système |
Avanc. |
n
(Aℓ3+)
|
n
(HO–) |
|
n
(Aℓ(OH)3) |
|
État initial
(mmol) |
x =
0 |
n0
(Aℓ3+) |
n0
(HO–) |
0 |
|
|
État
intermédiaire |
0
≤ x ≤ xf |
n0
(Aℓ3+) – x |
n0
(HO–) –
3
x |
x |
|
|
État final
(mmol) |
x = xf |
n0
(Aℓ3+)
– xf |
n0
(HO–)
–
3
xf |
|
xf |
|
Équation |
Aℓ3+
(aq) |
+
3
HO– (aq) |
→ |
Aℓ(OH)3
(s) |
|
|
État du
système |
Avanc.
mol |
n
(Aℓ3+)
mol |
n
(HO–)
mol |
|
n
(Aℓ(OH)3)
mol |
|
État initial
(mmol) |
x =
0 |
n0
(Aℓ3+) = 6,0 |
n0
(HO–) = 9,0 |
0 |
|
|
État
intermédiaire |
0
≤ x ≤ xf |
6,0
– x |
9,0
–
3
x |
x |
|
|
État final
(mmol) |
x = xf
=
xmax |
6,0
– xmax |
9,0
– 3
xmax |
|
xmax |
|
xmax
=
3,0 |
3,0 |
0 |
|
3,0 |
|
-
On
remarque que l’avancement x
est égal à la quantité de matière de diiode consommée.
-
On peut écrire :
n (I2)
= n1
– x
-
Au début de la
réaction, l’avancement x
= 0, puis l’avancement x
augmente au cours de la réaction pour atteindre la valeur
xf
lorsque l’état final est atteint.
L’avancement maximal :
xmax.
-
L’avancement maximal
xmax
correspond à la plus petite valeur de l’avancement pour laquelle la quantité
finale de l’un au moins des réactifs est nulle.
-
Ce réactif est alors
appelé : réactif limitant
Les transformations totales et non totales :
-
Toutes les
transformations chimiques ne sont pas totales.
-
Dans ce cas,
aucun des réactifs n’a totalement disparu lorsque le système cesse d’évoluer.
-
L’avancement
final est inférieur à l’avancement maximal.
-
Une
transformation est dite totale si l’avancement final xf
de la réaction est égal à son avancement maximal
xmax.
-
Une
transformation est dite non totale si
l’avancement final xf
de la réaction est inférieur à son avancement maximal
xmax.
-
Pour une
transformation non totale, il faut connaître la valeur de l’avancement final
xf
pour
effectuer le bilan de matière à l’état final.
Le mélange stœchiométrique :
-
Considérons la
réaction suivante :
a
A + b
B → c
D + d
D
- Un mélange initial est dit stœchiométrique si les quantités de matières initiales des réactifs sont
- dans les proportions des nombres stœchiométriques de l’équation de la réaction :
-
Les quantités de
matières initiales des réactifs vérifient la relation suivante :
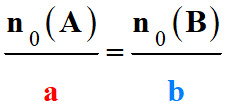
- Dans le cas d’une transformation totale et pour un mélange stœchiométrique,
- les quantités de
matières finales des réactifs sont nulles.
-
Seuls les produits de
la réaction et éventuellement les espèces spectatrices sont présents à l’état
final.
|
|