|
Évolution spontanée |
|
|
|
|
|
|
QCM N° 06
Évolution
spontanée
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
On introduit
initialement
des quantités de
matières n1
de phosphore P4
et n2 de
dibrome Br2,
qui réagissent
selon la
réaction :
P4
+ 6 Br2, → 4 PBr3
Pour un
avancement x, les
quantités de
matière sont : |
6 n2
– x
pour Br2
et
4 x
pour PBr3 |
n2
– 6 x
pour Br2
et
4 x
pour PBr3 |
n1
– x
pour P4
et
4 n1
pour PBr3 |
B |
|
2 |
On introduit
initialement
des quantités de
matières n1
de phosphore P4
et n2 de
dibrome Br2,
qui réagissent
selon la
réaction :
P4
+ 6 Br2, → 4 PBr3
La transformation
est totale.
S’il y a
disparition totale de
tous les
réactifs, alors : |
n1
= 6 n2 |
n2
= 6 n1 |
Dans l’état
final, la
quantité de
matière de
PBr3
vaut
4 n1. |
BC |
|
3 |
On fait réagir
3,0 mol de
dihydrogène H2
avec 2,0 mol
de diazote
N2 pour former de
l’ammoniac NH3
selon
la réaction :
3 H2
+ N2, → 2 NH3
À l’état final,
on obtient
1,7 mol
d’ammoniac. |
L’avancement
final est
égal à
1,7 mol |
L’avancement
final est
égal à
0,85 mol |
L’avancement
maximal est
égal à
0,85 mol |
B |
|
4 |
Lors d’une
réaction
acide-base :
|
Un ion
hydrogène
est transféré
de la base
d’un couple
vers l’acide
d’un autre
couple |
Un ion
hydrogène
est transféré
de l’acide
d’un couple
vers la base
d’un autre
couple |
L’acide
d’un couple
cède un ion
hydrogène
à sa base
conjuguée |
B |
|
5 |
On considère la
réaction
suivante :
H2CO3 (aq) +
CHO2–
(aq)
→
HCO3 – (aq) + CH2O2
(aq) Cette réaction met en jeu un
transfert d’ion
hydrogène de : |
CHO2– (aq)
Vers
HCO3 – (aq) |
H2CO3 (aq)
Vers
HCO3 – (aq) |
H2CO3 (aq)
Vers
CHO2– (aq) |
C |
|
6 |
Si
[H3O+]
= 8,00 × 10–4 mol.L–1,
le pH est
égal à : |
–3,10 |
3,10 |
8,00 |
B |
|
7 |
Si pH =
4,80,
[H3O+]
est égale à : |
1,58 × 105
mol . L–1 |
1,58 × 10–4
mol . L–1 |
1,58 × 10–5
mol . L–1 |
C |
|
8 |
L’équation de la
réaction
entre les ions
nitrate et le
cadmium
métallique est :
Cd
+ NO3– + 2 H+
→
Cd2+
+ NO2– + H2O |
L’ion NO3–
réagit avec
le cadmium
métallique
en lui cédant
deux électrons |
Le cadmium
métallique
cède deux
électrons
pour former
l’ion Cd2+ |
Deux
électrons
sont
transférés
au cours de
la réaction |
BC |
|
9 |
L’équation de la
réaction
entre les ions
nitrate et le
cadmium
métallique est :
Cd
+ NO3– + 2 H+
→
Cd2+
+ NO2– + H2O
Le cadmium
métallique : |
Subit une
oxydation |
Subit une
réduction |
est un
réducteur |
AC |
|
10 |
La demi-équation
du
couple SO42–
/ SO2 est |
SO2
+
2 H2O
→
SO42–
+ 4 H+
+ 2 e– |
SO2
+
2 e–
+ 2 H2O
→
SO42–
+ 4 H+ |
SO2
+
2 e–
+ 2 H2O
→
SO42–
+ 2 H+ |
A |
|
11 |
La réaction
d’oxydoréduction
entre
I2
et SO2 : |
a pour
équation
2 I2
+ SO2
+ 2
H2O
→
2 I–
+ SO42–
+ 4
H+ |
a pour
équation
I2
+ SO2
+ 2
H2O
→
2 I–
+ SO42–
+ 4
H+ |
Implique
un transfert
d’électrons
de I2
vers SO2. |
B |
|
12 |
D’après la loi de
Kohlrausch, la
conductivité
d’une
solution d’acide
chlorhydrique
(H3O
+ (aq) + Cℓ–
(aq)),
s’écrit : |
σ
=
λ
(Cℓ–)
. [Cℓ–]
+
λ
(H3O +) . [H3O
+] |
σ
=
λ
(Cℓ–)
. [Cℓ–]
×
λ
(H3O +) . [H3O
+] |
σ
=
λ
(H3O +) . [H3O
+] |
A |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
Quantités de matière et réaction chimique :
-
Il faut dresser le
tableau d’avancement de la réaction.
-
Tableau d’avancement :
|
Équation |
P4
+ |
6
Br2 |
→ |
4
PBr3 |
|
|
état |
Avanc.
x
(mol) |
n (P4)
(mol) |
n (Br2)
(mol) |
|
n (PBr3)
(mol) |
|
État initial |
x |
n1 |
n2 |
|
0 |
|
Au cours de la
transformation |
x |
n1 –
x |
n2 –
6
x |
4 x |
|
|
État final |
xf |
n1 –
xf
|
n2 – 6 xf
|
|
4 xf |
Transformation totale, mélange stœchiométrique :
-
Il faut dresser le
tableau d’avancement de la réaction.
-
Tableau d’avancement :
|
Équation |
P4
+ |
6
Br2 |
→ |
4
PBr3 |
|
|
état |
Avanc.
x
(mol) |
n (P4)
(mol) |
n (Br2)
(mol) |
|
n (PBr3)
(mol) |
|
État initial |
x |
n1 |
n2 |
|
0 |
|
Au cours de la
transformation |
x |
n1 –
x |
n2 –
6
x |
4 x |
|
|
État final |
xf |
n1 –
xf = 0
|
n2 – 6 xf
= 0 |
|
4 xf |
-
Il y a disparition de
tous les réactifs :
-
n1
– xf
= 0 et n2
– 6 xf
= 0
-
n1
= xf
et n2
= 6 xf
= 6
n1
-
et il se forme
4
xf =
4
n1
de PBr3
(tribromure de phosphore)
Avancement final, avancement maximal :
-
Il permet d’exprimer
les quantités de matière de réactifs et de produits présents dans le système
chimique à chaque instant, de l’état initial à l’état final.
-
L’avancement
x est une quantité
de matière. Elle s’exprime en mol.
-
Dans l’état initial,
x = 0 mol
-
au
cours de la transformation,
0 ≤ x ≤ xf
-
À l’état final :
x =
xf.
-
L’avancement
x d’une
réaction chimique augmente au cours d’une réaction chimique.
|
Avancement x |
||
|
0 |
→ |
xf |
-
L’avancement maximal :
xmax.
-
Définition :
-
L’avancement maximal
xmax
correspond à la plus petite valeur de l’avancement pour laquelle la quantité
finale de l’un au moins des réactifs est nulle.
-
Ce réactif est alors
appelé : réactif limitant.
-
Toutes les
transformations chimiques ne sont pas totales.
-
Dans ce cas,
aucun des réactifs n’a totalement disparu lorsque le système cesse d’évoluer.
-
L’avancement
final est inférieur à l’avancement maximal.
-
Une
transformation est dite totale si l’avancement final xf
de la réaction est égal à son avancement maximal
xmax.
-
Une
transformation est dite non totale si l’avancement final xf
de la réaction est inférieur à son avancement maximal
xmax.
|
Transformations totales et non totales :
Comparaison entre xf
et xmax :
-
Si xf
= xmax , alors la transformation est totale.
-
Si xf < xmax ,
alors la transformation est non totale. |
-
L’avancement maximal
permet de réaliser le bilan de matière, c’est-à-dire de calculer les quantités
de matière de toutes les espèces chimiques à l’état final.
-
Tableau d’avancement
de la réaction :
|
N2
(g) + |
3 H2
(g) |
|
2
NH3 (g) |
||
|
état |
Avanc.
x
(mol) |
n (N2)
(mol) |
n (H2)
(mol) |
|
n (NH3)
(mol) |
|
État initial |
x |
2 |
3 |
|
0 |
|
Au cours de la
transformation |
x |
2 –
x |
3– 3
x |
2 x |
|
|
État final |
xf |
2 –
xf |
3 – 3
xf |
|
2 xf =
1,7 |
|
État max |
xmax |
2 –
xmax |
3 – 3
xmax |
|
2 xmax = |
-
D’après le tableau
d’avancement :
-
2
xf =
1,7 mol
=> xf
=
0,85 mol :
-
n (N2)
= 2
– xf
=
1,15 mol
-
n (H2)
= 3
– 3 xf
=
0,45 mol
-
La réaction n’est pas
totale :
-
Détermination de
l’avancement maximal :
-
Hypothèse 1 :
N2
est le réactif limitant :
-
2
– xmax1
= 0 => xmax1
= 2 mol
-
Hypothèse 2 :
H2
est le réactif limitant :
-
3 – 3 xmax2
= 0 => xmax2
= 1 mol
-
En conséquence
l’avancement maximal xmax
= xmax2
= 1 mol
-
H2
est le réactif limitant et la réaction n’est pas totale : équilibre chimique
-
xf
< xmax
-
Écriture de l’équation
bilan :
|
Équation |
N2
(g) + |
3 H2
(g) |
|
2 NH3
(g) |
Réaction acidobasique :
-
Une réaction
acido-basique consiste à un transfert d'un proton (ion hydrogène) entre l’acide
A1H d’un
couple sur la base A2–
d’un autre couple.
-
Couple acide / base 1
: A1H ![]() H
+ +
A1–
H
+ +
A1–
-
Couple acide / base 2
: A2H ![]() H
+ +
A2–
H
+ +
A2–
-
Équation de la
réaction :
-
On se place dans le
cas où l’acide A1H
réagit sur la base A2–
A1H
+
A2–
![]() A1–
+
A2H
A1–
+
A2H
ou
A1H
+
A2–
→
A1–
+
A2H
-
Exemple :
|
CH3COOH
(aq) |
|
|
|
CH3COO
– (aq) |
+ |
H+ |
(1) |
|
Acide |
|
|
|
|
|
|
|
|
H2O
(ℓ) |
+ |
H+ |
|
H3O
+ (aq) |
|
|
(2) |
|
Base |
|
|
|
|
|
|
|
|
CH3COOH
(aq) |
+ |
H2O
(ℓ) |
|
CH3COO
– (aq) |
+ |
H3O
+ (aq) |
(1)+ (2) |
-
Autre exemple :
|
CH3COOH
(aq) |
|
|
|
CH3COO
– (aq) |
+ |
H+ |
(1) |
|
ACIDE |
|
|
|
|
|
|
|
|
NH3
(aq) |
+ |
H+ |
|
NH4
+ (aq)
|
|
|
(2) |
|
BASE |
|
|
|
|
|
|
|
|
CH3COOH
(aq) |
+ |
NH3
(aq) |
→ |
CH3COO
– (aq) |
+ |
NH4+ (aq)
|
(1) + (2) |
Réaction entre deux couples acide-base :
-
Acide formique (acide
méthanoïque) : 
-
Ion formiate ( ion
méthanoate) : 
-
Acide carbonique :  ou (CO2,
H2O)
ou (CO2,
H2O) , l'ion carbonate
CO32–
(aq)
, l'ion carbonate
CO32–
(aq)
 .
.
|
H2CO3
(aq) |
|
|
|
HCO3 –
(aq) |
+ |
H+ |
(1) |
|
CHO2–
(aq) |
+ |
H+ |
|
CH2O2
(aq)
|
|
|
(2) |
|
H2CO3
(aq)) |
+ |
CHO2–
(aq |
→ |
HCO3–
(aq) |
+ |
CH2O2
(aq |
(1) + (2) |
pH d’une solution aqueuse :
-
Le
pH
d’une solution est un indicateur d’acidité lié à la présence des ions oxonium
H3O+ (aq) en solution.
|
Pour une
solution diluée, [H3O+]
< 0,050 mol . L–1, Le pH
est défini par la relation suivante :
Cette relation
est équivalente à :
|
|
pH :
grandeur sans unité |
|
[H3O+] : concentration en ions oxonium en mol . L–1 |
|
C0 :
concentration standard : C0 = 1,0 mol . L–1 |
-
Exemple :
-
Valeur du
pH de la solution :
-

-
En toute rigueur, si
C0 =
1,0 mol . L–1, alors :
pH
≈ 3,1
Concentration en ion oxonium à partir de la valeur du pH
d’une solution :
-
pH
= 4,80 ;
-
[H3O+]
= C0
×10–
pH mol
. L–1
-
[H3O+]
= 1,0 × 10–
4,8 mol
. L–1
-
[H3O+]
= 1,58
× 10– 5 mol
. L–1
-
[H3O+]
= 1,6 × 10–
5 mol
. L–1
-
Remarques :
-
On
écrit aussi : pH = – log [H3O+] (relation
utilisée jusqu’en 2010)
-
Le
pH
d’une solution est mesuré avec un
pH-mètre.
-
Le
pH
augmente si [H3O+] diminue
et inversement.
La mesure du pH et sa précision :
-
Dans les conditions
habituelles, au lycée, on peut mesurer un pH,
au mieux, à 0,05 unité près (le plus souvent à 0,1 unité près).
-
Conséquences :
-
Une mesure de
pH effectuée à 0,05
unité près conduit à une valeur de la concentration [H3O+]
connue à 11,5 % près.
-
Une simple mesure de
pH ne peut
donner une concentration avec précision.
-
Il faut limiter le
nombre de chiffres significatifs pour représenter une concentration déduite de
la valeur du pH.
-
Toute concentration
déduite de la valeur du pH
sera exprimée avec 2 chiffres significatifs au maximum.
Chap N° 01 Transformations acidobasique.
Réaction d’oxydoréduction :
|
NO3–
(aq) + 2
H+
(aq) + 2
e –
|
|
( Cd
(s)
|
|
NO3–
(aq) + 2
H+
(aq) + Cd → NO2–
(aq) + Cd2+ (aq) +
H2O
(ℓ) |
-
Couple
Ox / Red :
-
Cd2+
(aq)
/
Cd (s)
et NO3–
(aq) / NO2–
(aq)
-
Cd
(s) est le
réducteur ; il est oxydé , il perd 2 électrons
-
NO3–
(aq) est l’oxydant, il est réduit, il gagne 2 électrons.
-
Un oxydant est une
entité chimique capable de gagner un ou plusieurs électrons.
-
(Oxydant :
gagne)
-
Un réducteur est une
entité chimique capable de perdre un ou plusieurs électrons.
-
(Réducteur :
perd)
-
L’oxydant est réduit
et le réducteur oxydé.
-
Une réduction est
un gain d’électrons.
-
Une oxydation est
une perte d’électrons.
-
Pour la réaction
considérée :
-
Cd
(s) est le réducteur ; il est oxydé : il subit une
oxydation , il perd 2 électrons.
Couple oxydant / réducteur :
-
Couple oxydant /
réducteur :
SO42– (aq) / SO2
(aq) :
-
Retrouver une
demi-équation électronique :
|
|
Demi-équation électronique |
|
Première étape :
On écrit le
couple
oxydant /
réducteur |
SO42–
(aq) |
|
Deuxième étape : On équilibre l’élément oxygène avec de l’eau |
SO42–
(aq)
|
|
Troisième étape : On équilibre l’élément hydrogène avec
H+
(on travaille en milieu acide) |
SO42–
(aq) + 4
H+
(aq) |
|
Quatrième étape : On équilibre les
charges avec les électrons. |
SO42–
(aq) + 4
H+
(aq) + 2
e– |
La réaction d’oxydoréduction
entre I2 et SO2 :
|
SO2
(aq) + 2 H2O
(ℓ)
|
|
I2
(aq) + 2 e
– |
|
I2
(aq)+ SO2 (aq) + 2
H2O
(ℓ) → 2 I– (aq ) + SO42–
(aq) + 4 H+ (aq)
|
-
Couple Ox / Red :
I2
(aq) /
I–
(aq) et
SO42–
(aq) / SO2
(aq)
-
L’oxydant I2
(aq) gagne (capte) 2 électrons, il
est réduit.
-
Le réducteur
SO2
(aq) perd (cède) 2 électrons, il est oxydé.
-
Il y a un transfert
d’électrons de SO2
(aq) vers I2
(aq).
Conductivité d’une solution :
-
Dans une solution
électrolytique, ce sont les ions qui sont responsables du passage du courant.
-
Un courant dans une
solution est dû à la circulation des ions positifs et négatifs se déplaçant en
sens inverse.
-
Chaque ion dans la
solution contribue à la conductivité de celle-ci.
-
La conductivité
σ de la solution
est égale à la somme
des conductivités
due aux cations
et aux anions.
-
On écrit :
-
σ
= σ (+) +
σ (–)
-
Formule générale :
-
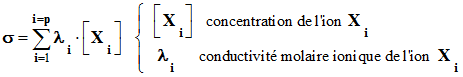
-
La conductivité
σ d’une solution
ionique dépend de la nature des ions présents Xi
et de leur concentration [ Xi
] respectives.
►
Exemple :
-
Pour une solution
aqueuse de chlorure d’hydrogène :
-
Solution d’acide
chlorhydrique : (H3O
+ (aq) + Cℓ–
(aq))
|
HCℓ
(g) + H2O (ℓ) |
→ |
H3O
+
(aq) |
+ |
Cℓ–
(aq) |
-
Or :
C = [Cℓ–]
= [H3O
+]
-
σ
= λ (Cℓ–)
. [
Cℓ–
] + λ
(H3O
+) . [ H3O
+ ]
-
σ
= {λ (Cℓ–)
+ λ (H3O
+) } . C
|
La conductivité σ d’une solution diluée d’une espèce ionique dissoute
est
proportionnelle à sa concentration molaire
C en soluté
apporté : |
|
σ =
k .
C |
|
σ
= k . C |
C ;
concentration en mol . L– 1
|
|
k :
coefficient de
proportionnalité en S . L .
m– 1. mol– 1
|
|
|
σ :
conductivité de
la solution en S . m– 1 |
- À partir de la mesure de la conductivité d’une solution, on peut déterminer la valeur de sa concentration.
Chap N° 02
Méthodes d'analyse physique
|
|