|
Cinétique chimique |
|
|
|
|
|
|
QCM N°
04
Cinétique
chimique
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
L’oxydant I2 :
|
Est réduit
en I–. |
Est oxydé
en I–. |
Perd des
électrons pour
former I–. |
A |
|
2 |
Soit la
demi-équation :
SO2
+ 2 H2O =
SO42–
+ 4 H+ + 2 e– |
SO2
subit une
oxydation |
SO2
est un
réducteur |
SO2
subit une
réduction |
AB |
|
3 |
L’équation de
la réaction
entre Ag+
et Cu est : |
Ag+
+ Cu
→
Ag
+ Cu2+ + e– |
Ag+
+ Cu
→
Ag
+ Cu2+ |
2 Ag+
+ Cu
→
2 Ag
+ Cu2+ |
C |
|
4 |
On s’intéresse
à la réaction
d’équation :
N2
+ 3 H2 → 2 NH3
On introduit
initialement
des quantités
de matière
n
de N2
et n’ de H2.
Dans la ligne
« quantité
de matière en
cours de
réaction », on
écrit : |
n
+ x
pour N2
et
n’
+ 3 x
pour H2 |
n
– x
pour N2
et
n’
– 3 x
pour H2 |
n
– x
pour N2
et
3 n’ –
x
pour H2 |
B |
|
5 |
On s’intéresse
à la réaction
d’équation :
N2
+ 3 H2 → 2 NH3
Si N2
est le réactif limitant,
sa quantité de
matière : |
Initiale est
inférieure
à celle de
H2 |
finale est
supérieure
à celle de
H2 |
Initiale
est nulle |
A |
|
6 |
On s’intéresse
à la réaction
d’équation :
N2
+ 3 H2 → 2 NH3
Si on
introduit
n
= 2,0 mol de N2
et n’ =
3,0 mol de H2 : |
N2
est
le réactif
limitant |
N2
est
introduit
en excès |
Le mélange
est
stœchiométrique |
B |
|
7 |
Lequel ou
lesquels de ces
schémas de
Lewis sont
justes :
|
|
|
|
C |
|
8 |
Le schéma de
Lewis de la
molécule
d’ammoniac est : |
|
|
|
C |
|
9 |
L’électronégativité d’un
élément
chimique mesure : |
Sa capacité à
repousser les
électrons
d’une
liaison de
valence |
Sa capacité à
attirer à lui
les électrons
d’une liaison
de valence |
Sa charge
négative |
B |
|
10 |
Une liaison
est polarisée
si les atomes
qu’elle relie : |
Sont
identiques |
Sont
différents |
Ont une
différence
d’électronégativité
supérieure à
0,4 |
C |
|
11 |
Une molécule
est
polaire si : |
Toutes les
liaisons sont
polarisées |
Elle possède
une seule
liaison
polarisée |
Elle contient
uniquement
des atomes
de carbone et
d’hydrogène |
B |
|
12 |
Laquelle ou
lesquelles
de ces
molécules sont
polaires ? |
|
|
|
AC |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
Réaction d’oxydoréduction
|
Couple
Ox
/ Red |
Demi-équation
électronique |
|
I2
(aq) / I– (aq) |
I2
(aq) + 2 e – |
-
Un oxydant est une entité chimique capable de gagner un ou plusieurs
électrons.
-
(Oxydant :
gagne)
-
Un réducteur est une entité chimique capable de perdre un ou plusieurs
électrons.
-
(Réducteur :
perd)
-
Couple oxydant / réducteur :
-
À tout couple oxydant / réducteur, on associe la demi-équation
électronique d’oxydoréduction suivante :
|
Ox |
+ |
n
e – |
|
Red |
-
Ceci est une écriture formelle.
-
La double flèche traduit la possibilité de passer d’une forme à l’autre
suivant les conditions expérimentales.
-
La transformation chimique qui correspond au passage de l’oxydant Ox
à son réducteur conjugué Red est une réduction : Ox + n e
– → Red
-
Une réduction est un gain d’électrons.
-
La transformation chimique qui correspond au passage du réducteur Red
à son oxydant conjugué Ox est une oxydation : Red → Ox + n e
–
-
Une oxydation est une perte d’électrons.
-
Au cours d’une réaction d’oxydoréduction, un oxydant est réduit et un
réducteur est oxydé.
-
Une réaction d’oxydoréduction est une réaction de transfert d’électrons.
-
Elle fait intervenir deux couples Ox / Red : Ox1
/ Red1 et Ox2 / Red2
-
Ox1 ne peut pas réagir sur Ox2 et
Red1 ne peut pas réagir sur Red2
-
Ox1 peut réagir sur Red2 ou Ox2
peut réagir sur Red1
-
Cela dépend de la force relative des oxydants et des réducteurs mis en
présence.
-
Au cours d’une réaction d’oxydoréduction :
-
Un oxydant est réduit et
-
Un réducteur est oxydé.
-
Exemples :
|
|
Oxydation |
|
|
Red |
→ |
Ox
+ n e– |
|
Cu |
→ |
Cu2+
+ 2 e– |
|
|
Réduction |
|
|
Ox
+ n e– |
→ |
Red |
|
Cu2+
+ 2 e– |
→ |
Cu |
-
Écriture condensée : exemple couple Cu2+ / Cu.
|
Oxydant et réducteur conjugué |
|||
|
Forme oxydée |
|
|
Forme réduite |
|
Cu2+
|
+
2 e– |
Réduction → |
Cu |
|
←
oxydation |
|||
|
Ox |
|
|
Red |
-
Exemple de couple oxydant / réducteur : Cu2+ / Cu.
-
Une réaction d’oxydoréduction est une réaction de transfert d’électrons.
-
Elle fait intervenir deux couples Ox / Red : Ox1
/ Red1 et Ox2 / Red2
-
Ox1 ne peut pas réagir sur Ox2 et
Red1 ne peut pas réagir sur Red2
-
Ox1 peut réagir sur Red2 ou Ox2
peut réagir sur Red1
-
Cela dépend de la force relative des oxydants et des réducteurs mis en
présence.
-
Au cours d’une réaction d’oxydoréduction :
-
Un oxydant est réduit et
-
Un réducteur est oxydé.
La réaction naturelle : Règle du gamma.
-
La réaction naturelle ou spontanée entre deux couples
Ox / Red fait
intervenir l'oxydant le plus fort et le réducteur le plus fort.
-
L'oxydant le plus fort réagit avec le réducteur le plus fort pour donner
l'oxydant le plus faible et le réducteur le plus faible.
-
Exemple :

-
Entre deux couples oxydant / réducteur la seule réaction, qui peut se
produire, est celle de l'oxydant le plus fort sur le réducteur le plus
fort : c'est la réaction naturelle.
-
La règle du gamma permet de retrouver le sens de la réaction
naturelle.
-
Remarque : Plus un réducteur est fort et plus son oxydant conjugué est
faible et inversement.
-
Classification électrochimique de quelques couples Ox / Red :

-
Si on met en présence les couples Ag+ (aq) / Ag
(s) et Cu2+ (aq) / Cu (s)
-
D’après la règle du gamma, il se produit la réaction suivante :

|
(Ag+
(aq) + e– |
2 |
|
Cu (s)
|
1 |
|
2
Ag+
(aq) +
Cu (s) →
2
Ag
(s) +
Cu2+ (aq)
|
|
Couple oxydant / réducteur :
Couple Ox / Red : SO42–
/ SO2
|
Couple Ox
/ Red |
Demi-équation électronique |
|
SO42–
(aq) / SO2 (aq) |
SO42–
(aq) + 2 e – + 4 H+
|
Réaction entre Ag+ et Cu :
|
(Ag+
(aq) + e
– |
|
( Cu
(s)
|
|
2
Ag+
(aq) + Cu
(s)
→
2 Ag
(s) + Cu2+ (aq) |
Tableau d’avancement :
|
Équation |
N2
(g) + |
3 H2
(g) |
→ |
2 NH3
(g) |
|
|
état |
Avanc. x
(mol) |
n
(N2) (mol) |
n
(H2) (mol) |
|
n
(NH3) (mol) |
|
État initial |
x |
n |
n’ |
|
0 |
|
Au cours de la
transformation |
x
|
n
– x |
n’–
3 x |
2 x |
|
|
État final |
xf |
n
– xf = 0 n
= xf |
n’
– 3 xf > 0 |
|
2 n |
Réactif limitant, proportions stœchiométriques
-
Si N2 est le réactif limitant :
-
n’ – 3 xf > 0 => n’ > 3 n => n < n’ / 3
-
donc n < n’
-
Si on introduit n = 2,0 mol de N2 et n’ =
3,0 mol de H2
-
On peut faire le raisonnement suivant :
-
Hypothèse 1 : N2 (g) réactif limitant :
-
n – xf1 = 0 => xf1 = n = 2,0 mol
-
Hypothèse 2 : H2 (g) réactif limitant :
-
n’ – 3 xf2 = 0 => xf2 = n’ / 3 ≈ 1,0
mol
-
comme xf2 < xf1
-
H2 (g) est le réactif limitant et N2
(g) est le réactif en excès.
-
Remarque : n = 2,0 mol et n’ = 3,0 mol les
proportions stœchiométriques ne sont pas respectées
-
Proportions stœchiométriques : 1,0 mol de N2 pour 3 moles
de H2.
-
Il y a trop de N2.
Schéma de Lewis de la molécule d’eau :
-
L’atome d’hydrogène
![]() possède
1 électron célibataire : il est monovalent.
possède
1 électron célibataire : il est monovalent.
-
L’atome d’oxygène
![]() possède 2 électrons
célibataires : il est divalent
possède 2 électrons
célibataires : il est divalent
|
La molécule d’eau H2O |
Mise en commun
|
Schéma de Lewis
|
-
L'atome d'oxygène cherche toujours à acquérir la
configuration électronique la plus stable qui est celle du gaz
rare le plus proche dans la classification périodique.
-
Pour acquérir une structure électronique en octet, l'atome
d'oxygène forme :
-
2 liaisons covalentes par la mise en commun de deux paires d’électrons.
-
Il acquiert ainsi la structure électronique externe du néon Ne.
-
Chaque atome d’hydrogène respecte la règle du duet (le gaz rare le
plus proche est l’hélium He).
-
Les paires d’électrons liées sont engagés dans une liaison covalente.
-
On parle aussi de paires liantes ou de doublets liants.
-
Les paires d’électrons libres ne sont pas engagés dans une liaison
covalente.
-
Elles sont attachées à un seul atome.
-
On parle de paires non liantes ou de doublets non liants.
-
L’atome d’oxygène possède 2 paires liantes et 2 paires non liantes
-
Chaque atome d’hydrogène possède une paire liante.
Schéma de Lewis de la molécule d’ammoniac :
-
La molécule d’ammoniac : NH3


-
Schéma de Lewis de la molécule d’ammoniac :
-
Schéma de Lewis de l’atome d’azote : ![]()
-
Schéma de Lewis de l’atome d’hydrogène : ![]()
-
L'atome d'azote cherche toujours à acquérir la configuration électronique
la plus stable qui est celle du gaz rare le plus proche dans la classification
périodique.
-
Pour acquérir une structure électronique en octet, l'atome d’azote
forme :
-
3 liaisons covalentes par la mise en commun de deux paires d’électrons.
-
Il acquiert ainsi la structure électronique externe du néon Ne.
-
Chaque atome d’hydrogène respecte la règle du duet (le gaz rare le
plus proche est l’hélium He)

Électronégativité d’un élément chimique :
-
L'électronégativité traduit la tendance qu'a un atome d'un élément engagé
dans une liaison avec un autre atome d'un autre élément à attirer vers lui le ou
les doublets de liaison.
-
On utilise l'échelle d'électronégativité établie par le chimiste
américain PAULING (1932).
- l a attribué à chaque élément un nombre mesurant son électronégativité noté chi ou khi : χ.
- L’électronégativité varie selon la place de l’élément dans la classification périodique, ceci à l’exception des gaz nobles.
- Cette propriété est liée à la règle du duet et de l’octet.
- Sur une même ligne, l’électronégativité augmente de gauche à droite.
-
Dans une même colonne,
elle augmente de bas en haut.
-
Échelle d’électronégativité : classification périodique réduite.
-
- L'échelle d'électronégativité :
-
Augmente de gauche à droite d'une période donnée.
-
Et du bas vers le haut d'une colonne donnée.
Liaison covalente polarisée :
-
Une liaison covalente est dite polarisée lorsque le ou les
doublets de liaison ne sont pas répartis équitablement.
-
Il apparaît une charge partielle positive sur un atome et une
charge partielle négative sur l'autre atome.
-
Plus la différence d'électronégativité entre les deux atomes est
importante, plus la liaison est polarisée.
-
La charge partielle négative est portée par l'atome le plus
électronégatif et la charge partielle positive est portée par l'atome le moins
électronégatif.
-
Considérons la molécule
AB de formule développée A―B :
-
Si χ (A)
> χ (B) avec
χ (A) –
χ (B) ≥ 0,4,
alors la liaison A―B est
polarisée
 ou
ou
![]()
-
La grandeur q représente une charge partielle.
Molécule polaire :
Schéma de Lewis de la molécule de méthanal :
 ou
ou 
De la structure à la polarité des
espèces chimiques
Polarité de la molécule d’éthanal :
-
Le carbone et l’hydrogène ont des
électronégativités voisines, alors que l’oxygène a une électronégativité plus importante.
-
Les liaisons carbone-hydrogène sont très
peu polarisées.
-
Alors que la liaison carbone-oxygène est
très polarisée.
-
On peut négliger la polarisation de la
liaison carbone-hydrogène devant celle de la liaison carbone-oxygène.
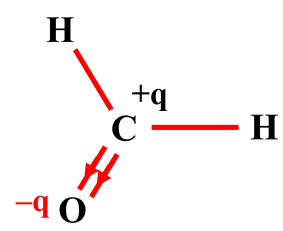
-
Il découle de ceci que la molécule de
méthanal est polaire.
-
Les positions moyennes des charges
partielles positives (G+) et négatives (G–) ne sont pas confondues.
- Une molécule polaire est soluble dans un solvant polaire.
-Le chlorure
d’hydrogène est constitué de molécules HCℓ
dans lesquelles l’atome d’hydrogène est lié à l’atome de chlore par une liaison
covalente.
|
Représentation
de Lewis |
Caractéristiques
géométriques |
|
|
|
|
dH – Cℓ
≈
127 pm |
-Le chlore est beaucoup
plus électronégatif
que l’hydrogène.
-Il attire vers lui le
doublet de liaison : on dit que la liaison H –
Cℓ est polarisée.
-Cette polarisation
fait apparaître :
-Un excédent de charge
négative, noté –q,
sur l’atome de chlore (qreprésente une charge partielle).
-Un excédent de charge
positive, noté +q,
sur l’atome d’hydrogène.
-La molécule de
chlorure d’hydrogène a un caractère dipolaire : elle constitue un dipôle
électrique.
-Elle peut être
représentée par un dipôle portant les charges–q et+q
|
|
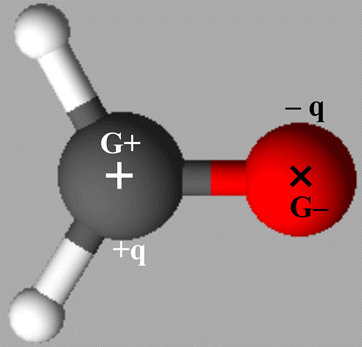
Molécule d’eau : molécule polaire
Représentation :

-La molécule étant
coudée, les positions moyennes des charges partielles positives et négatives ne
sont pas confondues : la molécule d’eau est polaire.
-
Le barycentre des charges positives G+ n’est pas
confondu avec le barycentre des charges négatives G–.
-
Molécule de dioxyde de carbone :
-
Les liaisons carbone oxygène C = O sont
polarisées.
-
La molécule de dioxyde de carbone n’est pas polaire car
G+ et G– sont confondus.
On donne une
indication :
-L’atome d’oxygène est
plus électronégatif que l’atome de carbone.
|
Représentation
de Lewis |
Caractéristiques
géométriques |
|
|
|
|
molécule
linéaire
dC – O
≈ 116 pm |
-L’oxygène est plus
électronégatif que le carbone.
-Les deux liaisons
covalentes O = C
d’une molécule de dioxyde de carbone sont polarisées.
-Il en résulte
l’apparition de charges partielles - q
sur chaque atome d’oxygène et d’une charge partielle
2 (+ q) sur
l’atome de carbone.
-Mais la molécule de
dioxyde de carbone est une molécule linéaire.
- Du fait
de la géométrie de la molécule, les positions moyennes des charges partielles
positives (G+) et négatives (G–)
sont confondues.
-La molécule de dioxyde
de carbone est apolaire.
![]() Conclusion :
Conclusion :
-Une molécule est
polaire si les positions moyennes des charges partielles positives et négatives
ne sont pas confondues.
-Une molécule est
apolaire dans le cas contraire.
La molécule de sulfure d’hydrogène :
-
La molécule de sulfure de dihydrogène n’est pas une
molécule linéaire.
-
En conséquence, le barycentre des charges négatives
G– n’est pas confondus avec le barycentre des charges positives G+.
-
La molécule de sulfure de dihydrogène H2S
est polaire comme la molécule d’eau H2O :



-
Le soufre est plus électronégatif que l’hydrogène.
-
Néanmoins les liaisons S – H sont moins
polarisées que les liaisons O – H.
-
De même la molécule de méthanol CH3OH
est polaire :
-
L’oxygène est plus électronégatif que le carbone et
l’hydrogène.

-
La molécule d’éthyne H2C2
n’est pas polaire.
-
On considère que la liaison C – H n’est
pas polarisée.
-
De plus la molécule n’est pas polaire car elle est
linéaire comme la molécule de dioxyde de carbone.
![]()

|
|