|
|
 |
|
Exercices :
a)-
Nommer des mélanges : exercices 5 page 25.
b)-
Exploiter un graphique T = f (t). Exercice 8 page
25.
c)-
Déterminer une densité : Exercice 11 page 35.
d)-
Analyser un chromatogramme : Exercice 15 page 25.
e)-
Des caractéristiques physiques différentes : Exercices 17 page 26.
f)-
L’acide fumarique : Exercice 25 page 26.
|
I-
Quelques définitions.
1)-
Définition de l’espèce chimique.
a)-
Une espèce chimique
correspond à un ensemble d’entités chimiques
identiques.
– Elle est représentée par une formule chimique.
– Comme entité chimique, cette année, on travaille avec les atomes, les
molécules et les ions.
– Un ensemble de molécules identiques constitue une espèce chimique.
–
Cette espèce chimique a de ce fait une structure moléculaire.
–
Exemple :
–
L’eau est une espèce chimique constituée de molécules identiques : la
molécule d’eau de formule brute H2O.
–
Un ensemble d’atomes de fer constitue une espèce chimique. Sa formule est
Fe.
–
Le fer a une structure atomique
–
À l’état solide, il est constitué d’un assemblage compact et ordonné
d’atomes de fer..
–
Remarque : Toute espèce chimique peut être représentée par une formule.
–
Additif :
–
Le chlorure de sodium (sel de cuisine) est une espèce chimique.
–
Il n’a pas une structure moléculaire mais une structure ionique.
–
On le représente aussi par une formule chimique
NaCℓ qui n’a pas
bien la même signification que celle de l’eau.
–
Le chlorure de sodium est un cristal.
–
Il est formé d’un assemblage compact et ordonné d’ions chlorure et d’ions
sodium.
–
La formule du chlorure de sodium est une formule statistique.
–
Elle traduit le fait que dans le cristal, il y a autant d’ions chlorure
que d’ions sodium.
–
La molécule d’eau est un édifice formé d’un nombre limité d’atomes.
–
Questions : le coca-cola est-il une espèce chimique ? Le lait ? Le miel ?

2)- Les Corps purs.
–
Un corps pur
est constitué d’une seule espèce chimique
–
Un corps pur possède une formule chimique
–
Un corps pur possède des constantes physiques spécifiques :
–
température
de fusion, température d’ébullition, masse volumique, indice de réfraction…
–
Exemple : le dioxygène ;
O2, le diazote ;
N2,
éthanol ; CH3CH2OH

3)-
Les mélanges.
a)-
Définition.
–
Un mélange est constitué de plusieurs espèces chimiques.
–
Un mélange ne possède pas de formule chimique
–
Un mélange est constitué d’espèces chimiques différentes.
–
Il ne peut pas
être représenté par une formule chimique.
–
Ainsi l’air est un mélange de dioxygène
O2, de diazote
N2, l’argon
Ar,…
–
On ne donne pas de formule chimique à l’air.
–
On peut donner la formule chimique des constituants de l’air.
b)-
Complément scientifique.
–
La composition d’un mélange peut être décrite par le pourcentage massique
–
ou le pourcentage volumique de chacune des espèces présentes dans ce mélange.
–
La composition d’un mélange, comme l’air peut être décrite par la
proportion en volume,
–
de chacune des espèces chimiques qui le constituent
–
L’air est un mélange gazeux, il est composé principalement
–
De diazote (78 %)
–
De dioxygène (21 %)
–
Il contient aussi les gaz suivants (total ≈ 1 %)
–
Les gaz rares tels que l’argon, le néon, l’hélium…
–
Le dioxyde de carbone
–
La vapeur d’eau…
–
Tableau : Pourcentage volumique de l’air.
|
Air
|
Mélange : Proportions en volume
|
|
Constituants
|
Diazote
|
Dioxygène
|
Autres gaz
|
|
Formule
|
N2
|
O2
|
-
|
|
100
|
78
|
21
|
1
|
–
Additif :
–
La proportion en volume d’une espèce
E dans un mélange est le
quotient
–
du volume V (E) de cette espèce
–
par le volume total Vtot
du mélange.
–
Formulation :

–
Lorsqu’il est exprimé en pourcent (%), ce rapport est nommé pourcentage
volumique.
–
En conséquence, il y a 21 L de dioxygène dans 100 L d’air.
c)-
Les différents types de mélanges.
–
On peut classer les mélanges en deux catégories :
–
Les mélanges homogènes : on ne peut pas différencier à l’œil nu les
constituants
–
Les mélanges hétérogènes : on peut différencier à l’œil nu au moins deux
constituants
–
Exemples :
–
L’eau sucrée : dans un erlenmeyer, on place un sucre en morceau.
–
Puis, on verse de l’eau et on agite. Après agitation, le sucre a disparu
–
On dit que le sucre se dissout dans l’eau.
–
On obtient de l’eau sucrée qui est une solution aqueuse
–
L’eau et le sucre sont des corps purs et l’eau sucrée est un mélange.
–
L’eau sucrée contient des molécules de sucre parmi des molécules d’eau.
–
L’eau et l’huile : dans un tube à essais, on verse de l’eau
–
On ajoute de l’huile et on agite. On obtient une émulsion.
–
Après repos, on remarque que l’huile surnage au-dessus de l’eau.
–
L’huile et l’eau forment un mélange hétérogène.
–
De même l’eau et le sable forment un mélange hétérogène.

II-
Identification des espèces.
1)- Par les grandeurs physiques.
a)-
Introduction.
–
Un corps pur possède des constantes physiques spécifiques :
–
Température de changement d’état, : température de fusion, température
d’ébullition,
–
Masse volumique, indice de réfraction…
b)-
La masse volumique :
–
Relation :
|

|
–
m
: Masse de l’espèce ou du mélange en g
–
V
: Volume l’espèce ou du mélange en L
–
ρ :
Masse volumique de l’espèce ou du mélange en g / L
|
–
Remarque : on exprime aussi les masses
volumiques en g / cm3 ou g / mL
–
Rappel : 1 m3 = 103 dm3 = 106
cm3 = 103 L
–
La masse volumique d’une espèce chimique dépend de la température.
c)-
La densité.
–
La densité
des liquides et des solides se mesure par rapport à l’eau.
–
La densité des gaz se mesure par rapport à l’air.
–

–
Relation : on écrit :
|

|
La densité est
un nombre qui s’exprime sans unité
|
–
Connaissant la masse volumique du liquide, on
peut utiliser la relation suivante.
–
Pour le solide ou le liquide : m =
ρ .
V et pour l’eau :
meau=
ρeau
. V
–
Conséquence : On en déduit la relation suivante :
–

–
La densité est un nombre qui n’a pas d’unité.
–
Masse volumique de l’eau : ρeau = 1,0 kg / dm3
ou ρeau = 1,0 g / cm3 ou
ρeau
= 1,0 g / mL
–
Pour les gaz, la référence est l’air.
–
La relation est la suivante :
|

|
La densité est
un nombre qui s’exprime sans unité
|
–
La masse volumique de l’air dépend de la température et de la pression.
–
Pour une température θ = 0 °C et pour une pression p = 1013
hPa,
–
La masse volumique de l’air :
ρair = 1,29 g / L
–
La masse volumique de l’air est petite par rapport à celle de l’eau
–
L’état gazeux est un état dispersé alors que l'état liquide est un état
condensé.
–
Exemples :
|
Exemple 1 :
L’hexane a une
masse volumique égale à 660 kg . m– 3
et l’eau liquide
a une masse volumique égale à 1000 kg . m– 3.
Calculer la
densité de l’hexane.
Réponse :
Densité de l’hexane :

|
|
Exemple 2 :
Le
dichlorométhane a une densité de 1,326.
Calculer sa
masse volumique en g . cm – 3.
Donnée :
L’eau liquide a
une masse volumique égale à 1000 kg . m– 3.
Réponse :
Masse volumique
du dichlorométhane :

|
|
Exemple 3 :
Le dioxyde de
carbone est un gaz qui trouble l’eau de chaux.
Il fait partie
des gaz à effet de serre.
Pour une
température θ = 0 °C et une pression p = 1013 hPa,
Sa masse
volumique ρ = 1,96 g / L.
Calculer sa
densité. Quelle remarque peut-on faire ?
Donnée : la
masse volumique de l’air dans
les mêmes
conditions de température et de pression :
ρair
= 1,29 g / L
Réponse :
Densité du
dioxyde de carbone :

Le dioxyde de
carbone est un gaz plus dense (plus lourd) que l’air.
|

2)- Par des tests chimiques.
a)-
Test au sulfate de cuivre anhydre.
–
C’est une poudre blanche qui bleuit en présence d’eau.
–
Ce test est spécifique de la présence d’eau.
 Mode opératoire :
Mode opératoire :
–
À l’aide d’une spatule, déposer un peu de sulfate de cuivre II anhydre
dans une coupelle.

–
Laisser tomber une à deux gouttes de produit à tester.

–
Résultat du test : le test est positif si la poudre blanche bleuit.
–
Le test est négatif si la poudre blanche ne bleuit pas.
b)-
Test à l’eau de chaux.
–
L’eau de chaux est un liquide transparent qui se trouble en présence de
dioxyde de carbone.
–
Ce test est spécifique de la présence de dioxyde de carbone.
–
On peut schématiser le mode opératoire de ce test.

–
Lors de cette réaction chimique, on observe un dégagement gazeux.
–
On fait buller ce gaz dans de l’eau de chaux, liquide transparent.
–
Ce gaz provoque le trouble de l’eau de chaux.
–
C’est du dioxyde du carbone CO2.
c)-
Test au papier pH.
–
Ce test révèle la présence d’espèces chimiques acides, neutres ou
basiques.
–
Il n’est pas spécifique d’une espèce chimique.
 Mode opératoire :
Mode opératoire :
–
On plonge un agitateur en verre dans la solution à tester.
–
On met en contact l’extrémité de l’agitateur et un morceau de papier
pH
placé dans une coupelle.
–
Résultat du test :
–
On déduit à l’aide de l’échelle des teintes de
pH un ordre de grandeur de
la valeur du pH de la solution.

Cliquer sur l'image pour l'agrandir
d)-
Test à la liqueur de Fehling.
–
La liqueur de Fehling est un liquide bleu qui par chauffage en présence
de certains sucres donne un précipité rouge brique.
–
Ce test est spécifique de la présence de certains sucres (comme le
glucose).
–
On verse de la Liqueur de Fehling dans un tube à essais, on ajoute un peu
de la solution à tester.
–
On adapte une pince en bois pour tenir le tube à essais.
–
On chauffe modérément tout en observant le tube à essais.
–
Si un précipité rouge brique apparaît, le test est positif.

e)-
Le test du dioxygène.
–
On présente un bâton de bois incandescent à l’ouverture d’un flacon
contenant du dioxygène gazeux.
–
Le gaz présent dans l’éprouvette ravive la
combustion
–
Le gaz qui ravive la combustion d’une
bûchette incandescente est le dioxygène
O2
–
Ce test est spécifique de la présence du dioxygène.

Cliquer sur l'image pour l'agrandir


f)-
Le test du dihydrogène
–
on
présente rapidement une allumette enflammée à l’ouverture d’une éprouvette
contenant du dihydrogène gazeux
–
Il se produit une faible détonation
–
Le gaz qui
provoque une légère détonation en présence d’une flamme est de dihydrogène
H2.
–
Ce test est spécifique de la présence du dihydrogène.
–
Réaction :
–
On verse du fer en poudre dans un tube à essais.
–
On ajoute de l’acide chlorhydrique concentré.
–
Il se produit une vive effervescence et on observe un dégagement gazeux.
–
On ferme le tube à essai avec un bouchon et on laisse agir quelques
minutes.
–
On enlève le bouchon et on approche une allumette enflammée de
l’ouverture du tube à essai.
–
Il se produit une légère détonation.


–
Le gaz produit lors de cette réaction est du dihydrogène.

3)-
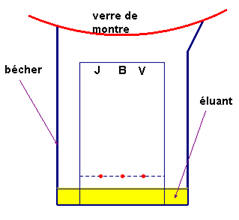
Par la chromatographie.
Chromatographie sur couche
mince (C.C.M)
(Sous forme de travaux pratiques)
a)-
Introduction
–
Cette technique permet de séparer les espèces chimiques présentes dans un
mélange homogène.
–
Pour effectuer une C.C.M, on utilise :
–
Une phase fixe sur laquelle une goutte de mélange à séparer est déposée.
–
La phase fixe est constituée d’une mince couche de gel de silice déposée
sur une plaque d’aluminium.
–
Une phase mobile ou éluant.
–
C’est le solvant dans lequel les constituants du mélange sont plus ou
moins solubles.
–
L’éluant migre le long de la phase fixe grâce au phénomène de
capillarité.
–
Il entraîne les constituants du mélange qui se déplacent à des vitesses
différentes.
–
On peut ainsi les séparer.

b)-
Chromatographie et séparation.
–
La chromatographie permet la séparation des constituants d’un mélange.
–
Pour un éluant et un support donnés, une espèce chimique migre de la même
façon qu’elle soit pure ou dans un mélange.
–
Une espèce chimique très soluble dans l’éluant migre beaucoup plus vite
qu’une substance peu soluble.
–
Les espèces chimiques étant entraînées à des vitesses différentes peuvent
être séparées.
c)-
Chromatographie et analyse.
–
La chromatographie est aussi une technique d’analyse.
–
Elle permet d’identifier les espèces chimiques présentes dans un mélange.
–
Des espèces chimiques identiques migrent à des hauteurs identiques sur
une même plaque de chromatographie.
–
Préparation de la plaque ;
|
Étape 1 :

|
Étape 2

|
Étape 3

|
|
Placer la plaque dans le
bécher et recouvrir du
verre de montre.
Laisser évoluer l’ensemble
jusqu’à ce que l’éluant
arrive à 1 cm du haut de
la plaque environ.
Sortir la plaque et
laisser sécher.
|
|

|


Animation
: réalisation d'une C.C.M

III-
Applications.
1)- Les Solutions hydroalcooliques. Préparation d’une
solution :
a)-
Introduction.
–
Les Solutions hydroalcooliques sont utilisées pour désinfecter les mains.
–
Ce sont des antiseptiques.
–
Elles contiennent de l’éthanol, du glycérol, de l’eau oxygénée et de
l’eau distillée.
–
Elles s’appliquent sur les mains sèches et ne nécessitent pas de rinçage.
b)-
Composition d’une solution hydroalcoolique.
–
Tableau :
|
|
Pourcentage
volumique
|
Densité
|
|
Éthanol à 96 %
|
85,0 %
|
0,806
|
|
Eau oxygénée à 10 vol.
|
4,00 %
|
1,01
|
|
Glycérol
|
1,50 %
|
1,26
|
|
Eau distillée
|
qsp 100 mL
|
1,00
|
Questions :
–
Effectuer une recherche sur les différentes espèces chimiques présentes dans
la solution hydroalcoolique.
–
Déterminer les volumes des différentes espèces chimiques pour préparer
100 mL de solution.
–
Déterminer les masses des différentes espèces chimiques pour préparer 100
mL de solution.
–
Élaborer un protocole expérimental afin de préparer 100 mL de solution
hydroalcoolique.
–
Préciser le matériel utilisé et les différentes étapes.

2)- Les solutions d’eau oxygénée.
–
La solution aqueuse de peroxyde de dihydrogène est plus connue sous le
nom d’eau oxygénée.
–
L’eau oxygénée dite à « 10 volumes » a un pourcentage massique en
peroxyde de dihydrogène égal à 3,0 %.
–
On trouve également des solutions à 10 %, 30 %, etc.
a)-
L’eau oxygénée est-elle un corps pur ?
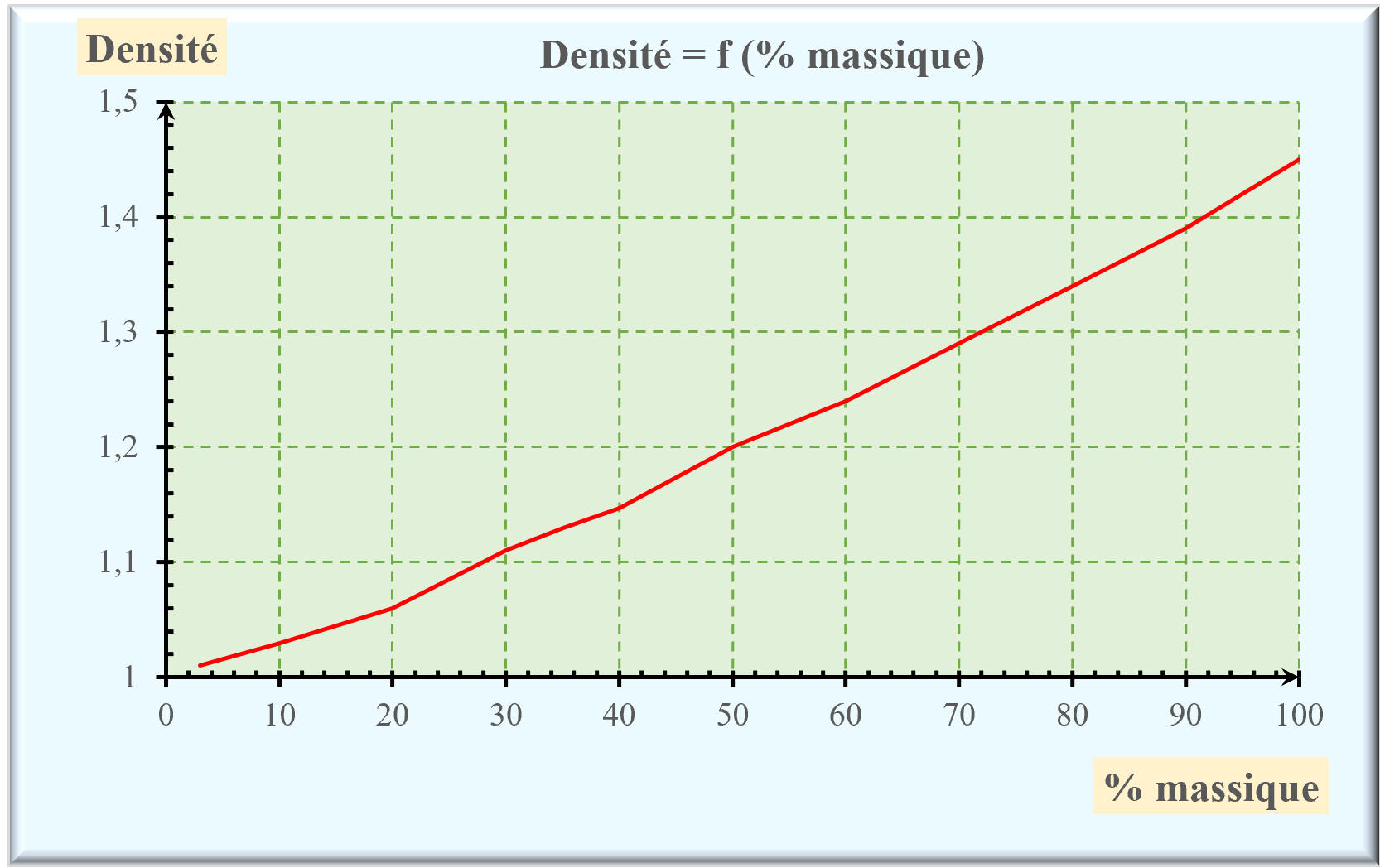
b)-
Il est possible de tracer l’évolution de la densité des solutions de
peroxyde de dihydrogène en fonction du pourcentage massique en hydroxyde de
dihydrogène :
–
Graphe :
–
Comment la densité d
des solutions de peroxyde de dihydrogène
évolue-t-elle en fonction du pourcentage massique en peroxyde de dihydrogène ?
–
Déterminer la valeur de la densité d’une solution à 50 %.
c)-
Calculer la masse de peroxyde de dihydrogène contenue dans 1,0 L de
solution à 50 %.
d)-
Élaborer un protocole expérimental pour déterminer le pourcentage
massique d’une solution inconnue de peroxyde de dihydrogène.
–
Tableau : Concentration en H2O2 :
Pourcentage massique
|
Paramètres
|
Concentration en H2O2 :
pourcentage massique
|
|
|
10 %
|
30 %
|
35 %
|
50 %
|
60 %
|
70 %
|
100 %
|
|
Masse
volumique
g
/ mL
|
1,03
|
1,11
|
1,13
|
1,20
|
1,24
|
1,29
|
1,45
|
|
Température
de fusion
°
C
|
-6
|
-26
|
-33
|
-52
|
-56
|
-40
|
-0,43
|
|
Température
d’ébullition
°
C
|
102
|
106
|
108
|
114
|
119
|
125
|
150
|

3)-
Correction :
4)-
Exercices :
a)-
Nommer des mélanges : exercices 5 page 25.
b)-
Exploiter un graphique T = f
(t). Exercice 8 page
25.
c)-
Déterminer une densité : Exercice 11 page 35.
d)-
Analyser un chromatogramme : Exercice 15 page 25.
e)-
Des caractéristiques physiques différentes : Exercices 17 page 26.
f)-
Des tests de mise en évidence : Exercice 22 page 26.
g)-
L’acide fumarique : Exercice 25 page 26.
5)- QCM :
QCM N° 01 Corps purs et mélanges
(réalisé avec QUESTY pour s'auto-évaluer)
sous forme de tableau



























