|
|
|
Contrôle N° 01 Propriétés des désintégrations radioactives. |
Énoncé |
|
1. Désintégration du carbone 14.
|
On donne Les numéros atomiques suivants : Z = 6 pour le carbone (C) et Z = 7 pour l’azote (N).
1.1.
Pourquoi les noyaux de symboles
1.2.
Donner la composition du noyau de symbole
1.3.
Le carbone 14 se désintègre en azote 14.
1.3.1.
énoncer les lois de
SODDY.
1.3.2.
écrire l’équation
de désintégration du carbone 14 en supposant que le noyau fils n’est pas
obtenu dans un état excité. Indiquer le type de radioactivité observé. |
2. Propriétés des désintégrations radioactives.
|
2.1. Donner les caractéristiques des transformations radioactives en complétant les phrases du tableau suivant.
2.2. Donner la loi de décroissance radioactive en précisant la signification et l’unité de chaque lettre. |
3. Temps de demi-vie et constante radioactive.
|
3.1. Donner la définition du temps de demi-vie d’un échantillon radioactif que l’on notera t ½ .
3.2.
retrouver
l’expression littérale de la durée de demi-vie en fonction de la constante
radioactive
à partir de la loi de décroissance :
3.3. Le temps de demi-vie de l’isotope du carbone 14 est t ½ = 5,70 x 10 3 ans. En déduire la valeur de la constante radioactive λ en seconde (1 an = 365,25 j) 3.4. L’activité A (t) d’un échantillon radioactif à l’instant de date t est donnée ici par l’expression : A (t) = λ . N (t). 3.4.1. Définir l’activité et donner son unité dans le système international.
3.4.2.
En utilisant cette expression et la loi de décroissance,
déduire
que
3.4.3. Sachant qu’au temps t = 0 s, l’activité de l’échantillon est A0 = 814 Bq. Calculer le nombre No de noyaux radioactifs présents dans l’échantillon à cette date. En déduire
le nombre de noyaux N
présents au bout d’une durée
Δt
= 5
t½. |
Le
radon 222
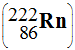 est issu
de la désintégration de
l’uranium 238
est issu
de la désintégration de
l’uranium 238 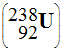 contenu
dans les roches terrestre.
contenu
dans les roches terrestre.
Calculer le nombre de désintégrations α et β– nécessaires pour passer de l’uranium 238 au radon 222. |
|
5.1. Demi-équations : il ne faut pas faire les choses à moitié. Équilibrer les demi-équations d’oxydoréduction des couples oxydant / réducteur suivants (le cas échéant, on supposera être en milieu acide H+).
On réalise l’oxydation des ions iodure I– (aq) (du couple I2 (aq) / I– (aq)) par les ions peroxodisulfate S2O82– (aq) (du couple S2O82– (aq) / SO42– (aq)). Pour ce faire, on mélange, à l’instant t = 0 s, un volume V1 = 100 mL d’une solution d’iodure de potassium de concentration C1 = 0,25 mol / L avec un volume V2 = 100 mL d’une solution de peroxodisulfate de sodium de concentration : C2 = 2,0 x 10 – 2 mol / L. 5.2.1. Écrire l’équation de la réaction d’oxydoréduction correspondante. 5.2.2. Calculer les quantités de matière de chacun des réactifs à l’instant initial. 5.2.4. Calculer la valeur de la concentration en diiode en fin de réaction. |