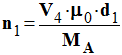|
|
Données :
|
|
M
g / mol |
densité |
Degré
de pureté |
|
|
Acide éthanoïque
|
60,05 |
1,05 |
99,9 % |
pKA = 4,8 |
|
Butan-1-ol |
74,12 |
0,810 |
99,9 % |
|
|
Solution de soude : (Na + (aq) + HO – (aq)) et
Concentration : CB
≈
4,88 mol / L
La densité
|
||||
Remarque : on peut considérer que les réactifs sont purs.
I- La réaction d’estérification.
|
La réaction d’estérification est la réaction d’un acide carboxylique sur un alcool.
Elle donne un ester et de l’eau. |
|
1)- Préparation du mélange : Dans un erlenmeyer de 250 mL, on mélange : un volume V3 = 91,51
mL de butan-1-ol et un volume V4 = 57,20
mL d’acide éthanoïque pratiquement pur. On met le mélange dans une burette
graduée et on remplit 14 tubes à essais de 10 mL de mélange. On prend un tube à essais que l’on note
A et on le met à part. 2)- Ajout du catalyseur : On ajoute une goutte d’acide sulfurique
concentré dans 14 tubes à essais que l’on bouche. On prend un tube à essais que l’on note
B et on le met à part. 3)- La durée : On place 12 tubes à essais au
bain-marie et on déclenche le chronomètre. On note la température du bain-marie :
θ = 70 ° C |
|
Dosage de l’acide éthanoïque restant : On prépare un bécher contenant 50 mL d’eau glacée.
A la date
t = 2 min, 4 min, …, on
verse le contenu
d’un tube à essais dans le bécher.
On ajoute 3 gouttes de phénolphtaléine. On dose l’acide éthanoïque restant par la soude et on note le volume VB de soude versée à l’équivalence
dans le tableau à la date
correspondante. |
|
1)- Le dosage de l’acide éthanoïque restant. a)- Déterminer les quantités de matière d’acide éthanoïque et de butan-1-ol introduits initialement dans l’erlenmeyer. Commenter. - Quantité de matière d’acide éthanoïque initialement présent dans l’erlenmeyer :
-
- Application numérique :
-
- Quantité de matière de butan-1-ol initialement présent dans l’erlenmeyer :
-
- Application numérique :
- - On a réalisé un mélange équimolaire d’alcool et d’acide carboxylique. - Les réactifs sont dans les proportions stœchiométriques. b)- Déterminer la quantité de matière n0A d’acide éthanoïque initialement présent dans chaque tube à essais. - Volume total de la solution :
- - Il y a 10 mL de solution dans chaque tube à essais :
-
c)- Pourquoi réalise-t-on la trempe du mélange avant le dosage ? - On effectue la trempe pour stopper la réaction d’estérification en agissant sur la température du milieu réactionnel qui est un facteur cinétique. d)- Écrire l’équation de la réaction de dosage de l’acide éthanoïque restant. Quelles sont les caractéristiques de cette réaction? - Équation de la réaction de dosage : cette réaction fait intervenir l’ion hydroxyde, la soude et l’acide éthanoïque :
CH3COOH
(aq) +
HO
–(aq)
= CH3COO
– (aq) + H2O
(ℓ)
- Additif :
-
- En conséquence :
- KR
= 10
pKe
– pKA
- KR
= 10 14 – 4,8
- KR
≈ 1,6
x 10 9 - La réaction est
quasi-totale car K
R
> 10 4. - C’est une réaction totale, rapide et unique (réaction de dosage).
CH3COOH
(aq) +
HO
–(aq)
→ CH3COO
– (aq) + H2O
(ℓ) e)- Donner l’expression littérale permettant de calculer la quantité de matière nA d’acide éthanoïque présent à la date t en fonction de CB et VB. - A l’équivalence, les réactifs ont été mélangés dans les proportions stœchiométriques (réaction de dosage).
- La quantité de matière d’acide éthanoïque
restant est égale à la quantité de matière d’ions hydroxyde (base)
ajouté.
- nA
= CB . VB f)- Écrire l’équation de la réaction d’estérification. g)- Dresser le tableau d’avancement de la réaction d’estérification (dans un tube). |
|
Équation |
Acide
carboxylique |
+ |
Alcool |
= |
Ester |
+ |
Eau |
|
État
initial |
n0A |
n0B
= n0A |
0 |
0 |
|||
|
Instant t |
n0A
– x |
n0A – x |
x |
x |
|
Temps
en min |
Volume de
soude versée |
acide éthanoïque restant dans
un tube à essais |
Ester formé dans un
tube à essais |
acide éthanoïque restant ramené
à une mole |
Ester formé ramené
à une mole |
|
|
t min |
VB en mL |
nA en mol |
nE
en mol |
n'A en mol |
n'E en mol |
|
|
0 |
13,70 |
|
|
|
|
|
|
2 |
13,00 |
|
|
|
|
|
|
4 |
12,35 |
0,060 |
0,007 |
0,901 |
0,098 |
|
|
8 |
11,20 |
0,055 |
0,012 |
0,817 |
0,182 |
|
|
10 |
10,70 |
0,052 |
0,015 |
0,781 |
0,219 |
|
|
15 |
9,55 |
0,047 |
0,020 |
0,697 |
0,303 |
|
|
25 |
7,90 |
0,039 |
0,028 |
0,576 |
0,423 |
|
|
30 |
7,30 |
0,036 |
0,031 |
0,533 |
0,467 |
|
|
40 |
6,40 |
0,031 |
0,036 |
0,467 |
0,533 |
|
|
45 |
6,10 |
0,030 |
0,037 |
0,445 |
0,554 |
|
|
60 |
5,40 |
0,026 |
0,041 |
0,394 |
0,606 |
|
|
70 |
5,10 |
0,025 |
0,042 |
0,372 |
0,627 |
|
|
100 |
4,70 |
0,023 |
0,044 |
0,343 |
0,657 |
|
b)- Déterminer le taux limite
d’estérification sachant qu’il s’exprime par le rapport Définir le rendement de la réaction et le calculer. - Taux limite d’estérification
-
- Rendement de la réaction - On peut améliorer le rendement d’une réaction limitée en ajoutant : - Un excès de l’un des réactifs de la réaction, - Ou en éliminant l’un des produits de la réaction.
-
- Ici
ρ
≈ 66 % - La réaction est limitée, il y a coexistence dans la même solution des réactifs et des produits. - Le système n’évoluant plus dans le temps. - Cet état est caractéristique d’un équilibre chimique. c)- Quel est le rôle des tubes A et B ? Commenter le résultat obtenu.
- Tube
A
- Tube
B
- A température ambiante, la réaction
d’estérification est très lente.
-
L’acide sulfurique est un catalyseur de
la réaction d’estérification. |
|
1)- Le graphe. a)- Tracer la courbe n’A = f (t) et n’E = f (t). |
|
b)- Donner les caractéristiques de
chaque courbe obtenue. En déduire les caractéristiques de la
réaction étudiée. - La courbe
n’A
= f (t)
est une fonction décroissante du temps et la courbe
n’E =
f (t) est une fonction croissante du temps. - La réaction
d’estérification est limitée. -
il existe une
réaction inverse qui est la réaction d’hydrolyse d’un ester.
- C’est aussi
une réaction limitée. c)- Donner la formule semi-développée de chaque molécule présente dans le milieu réactionnel. Indiquer la
classe de l’alcool utilisé. - Acide
éthanoïque (acide acétique) : CH3 ―COOH
- Butan–1–ol ou
butanol : - CH3
― CH2 ―CH2 ―CH2―OH
Alcool primaire - Ester :
- Eau : H2O d)- Mettre en évidence chacune des
fonctions organiques rencontrées.
e)- Comment appelle-t-on la réaction
inverse de la réaction d’estérification ? - La réaction
inverse de la réaction d’estérification est la réaction
d’hydrolyse d’un ester. f)- Comment peut-on augmenter la
vitesse de la réaction d’estérification ou d’hydrolyse ? - Pour
augmenter la vitesse de la réaction, on peut augmenter la
température du milieu réactionnel et
utiliser un catalyseur. - Le
catalyseur agit aussi bien sur la vitesse de la réaction
d’estérification ou d’hydrolyse. - Il
n‘agit pas sur la limite de la réaction. g)-Donner le nom d’un catalyseur de la
réaction. Modifie-t-il la limite d’estérification ? - Le
catalyseur utilisé ici est l’acide sulfurique en conséquence
les ions oxonium H3O+.
- Les ions
oxonium catalysent aussi bien la réaction d’estérification
que la réaction
d’hydrolyse. - Il
n’intervient pas sur la limite de la réaction. - Il ne
modifie pas la limite de la réaction d’estérification et
d’hydrolyse. h)- Comment peut-on améliorer le
rendement de la réaction ? - On peut
améliorer le rendement d’une réaction limitée en ajoutant : - Un excès de
l’un des réactifs de la réaction, - Ou en
éliminant l’un des produits de la réaction. |