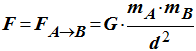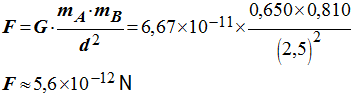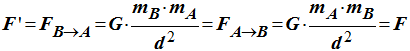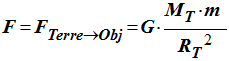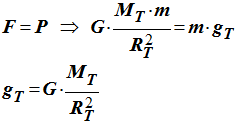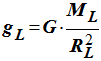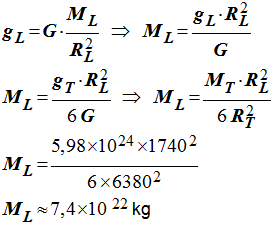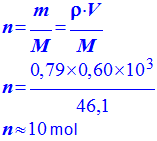|
Correction |
|
|
|
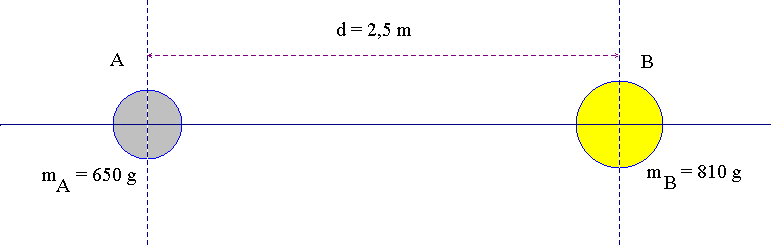
Deux boules de pétanques, l’une de centre A et de masse mA = 650 g, l’autre de centre B et de masse mB = 810 g, sont posées sur le sol. La distance entre leurs centres est d = 2,5 m. On donne : G = 6,67 x 10 – 11 m 3 . kg – 1 . s – 2 et g = 9,8 N / kg.
1)- Faire un schéma légendé de la situation
- Schéma légendé de la situation :
Cliquer sur l'image pour l'agrandir 2)- Donner
l’expression de la force F
de gravitation exercée par la boule A sur la boule
B.
- Expression de la force
F de gravitation exercée par la boule
A
sur la boule B :
- 3)- Calculer la valeur de la force F.
- Valeur de la force
F :
-
4)- La boule B exerce-t-elle une force de gravitation sur la boule A ? Si oui, donner la valeur F’ de cette force.
- Expression de la force
F' de gravitation exercée par la
boule B sur la boule
A :
- Réciproquement, la boule
B exerce une force sur la boule
A :
- |
|
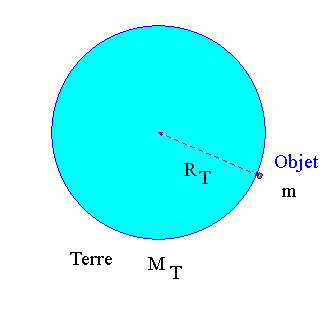
1)- Donner l’expression de la valeur de la force de gravitation F exercée par la Terre sur un objet de masse m posé sur le sol. On note : Masse de la Terre MT et rayon de la Terre RT.
- Expression de la valeur de la force de gravitation
F
exercée par
la Terre sur un objet de masse
m posé sur le
sol :
- Schéma de la situation :
- 2)- Donner l’expression du poids P de cet objet en fonction de sa masse m et de l’intensité gT de la pesanteur terrestre.
- P
= m .
g
T 3)- Sachant que F = P, donner l’expression de gT en fonction de G, RT et MT.
- Expression de gT :
-
4)- Par analogie, en déduire l’expression de gL de l’intensité de la pesanteur à la surface de la Lune en fonction de G, RL et ML.
- Expression de gL :
- 5)- L’intensité de la pesanteur à la surface de la Lune est six fois plus faible que l’intensité de la pesanteur à la surface de la Terre. Calculer la masse de la Lune.
- Masse de
-
|
|
On donne : G = 6,67 x 10 – 11 m 3. kg – 1 . s– 2 , RT = 6380 km et MT = 5,98 x 10 24 kg , RL = 1740 km. |
III-
Masse molaire, quantité de
matière et volume.
|
Données :
Masses
molaires atomiques : M (C) = 12,0 g / mol ; M (H) = 1,01 g / mol ; M (O) = 16,0 g / mol ;
M
(N) = 14,0 g / mol ;
M
(S)
= 32,0 g / mol Nombre d’AVOGADRO : NA = 6,02 x 10 23 mol – 1. Volume molaire dans les CNTP : Vm = 22,4 L / mol. |
|
1)- Calculer la masse molaire des corps purs suivants : a)- L’acide ascorbique (vitamine C) (C6H8O6).
- Masse molaire de la molécule d’acide ascorbique :
- M
(C6H8O6) =
- M
(C6H8O6)
≈
176 g / mol b)- La caféine : (C4H10O2N4).
- Masse molaire de
la molécule de caféine :
- M
(C4H10O2N4) =
4 M (C) + 10
M (H) +
- M
(C4H10O2N
4)
≈
146 g / mol c)- Calculer la quantité de matière contenue dans m = 1,00 g de chacune de ces substances.
- Quantité de
matière d’acide ascorbique :
- n
(C6H8O6)
= m (C6H8O6)
/ M (C6H8O6)
- n
(C6H8O6)
=
1,00
/ 176
- n
(C6H8O6)
≈ 5,68
x 10 – 3 mol
- Quantité de
matière de caféine :
- n
(C4H10O2N4)
= m (C4H10
O2N4)
/ M (C4H10O2N4)
- n
(C4H10O2N4)
=
1,00 /
146
- n
(C4H10O2N4) ≈ 6,85
x 10 – 3 mol d)- Calculer le nombre de molécules correspondant pour chaque substance.
- Nombre de
molécules d’acide ascorbique :
- N
(C6H8O6)
= n (C6H8O6)
.
N
A
- N
(C6H8O6)
= 5,68
x 10 – 3 x 6,02
x 10
23
- N(C6H8O6)
≈ 3,42
x 10 21 molécules
- Nombre de
molécules de caféine :
- N
(C4H10O2N4)
= n (C4H10O2N4)
.NA
- N
(C4H10O2N4)
= 6,85
x 10 – 3
x 6,02
x 10 23
- N
(C4H10O2N4)
≈ 4,12
x 10 21 molécules 2)- On remplit un flacon de volume V = 2,00 L de gaz diazote dans les conditions normales de température et de pression (CNTP). a)- Calculer la quantité de matière n (N 2) de diazote contenu dans le flacon dans les CNTP.
- Quantité de matière
n (N
2) de diazote contenu
dans le flacon dans les CNTP :
- n (N2) =
V
/ V m
- n (N2) = 2,00
/ 22,4
- n (N2)
≈
8,93
x 10 – 2 mol b)- Calculer la masse m (N2) de diazote contenu dans le flacon dans les CNTP.
- Masse
m (N2) de diazote contenu dans le flacon
dans les CNTP :
- m
(N2) =
n
(N2) .
M (N2)
- m
(N2) =
8,93
x 10 – 2
x
28,0
- m
(N2)
≈
2,50 g c)- Calculer le volume occupé par cette quantité de matière à 20 ° C et sous la pression de 1013 hPa. Le volume molaire des gaz dans ces conditions est Vm = 24,4 L / mol.
- Volume occupé par cette quantité de matière à 20 ° C et sous la pression
de 1013 hPa
- Vocc
= n
(N2) .
V
m
- Vocc
=
8,93
x 10 – 2
x
24,4
- Vocc
= 2,18 L 3)- L’éthanol est un liquide de formule (C2H6O) et de masse volumique ρ = 0,79 g / cm 3. a)- Calculer la masse molaire de l’éthanol.
- Masse molaire de
l’éthanol :
- M
(C2H6O) =
- M
(C2H6O)
≈ b)- Calculer la quantité de matière n d’éthanol contenue dans un volume V = 0,60 L d’éthanol.
- Quantité de
matière d’éthanol :
- |