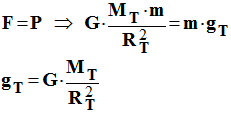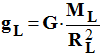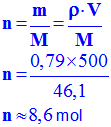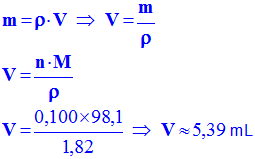|
|
|
1)- Donner l’expression de la valeur de la force de gravitation F exercée par
On note : Masse de
- Expression de la force
F :
-
2)- Donner l’expression du poids P de cet objet en fonction de sa
masse m et de
l’intensité gT
de
la pesanteur terrestre.
- Expression du poids
P :
- P
= m .
gT
3)- Sachant que F =
P, donner l’expression de
g
T
en fonction de G,
RT
et
MT.
- Expression de g
T :
-
4)- Par analogie, en déduire l’expression de gL de l’intensité de la pesanteur
à la surface de
- Expression de g
L :
-
5)- L’intensité de la pesanteur à la surface de
que l’intensité de la
pesanteur à la surface de
- Masse de
- |
|
On veut étudier l’influence de la longueur de L du pendule simple sur sa période T afin de compléter l’étude de Galilée. On utilise une sphère de cuivre
de rayon R
= Les résultats sont consignés dans le tableau.
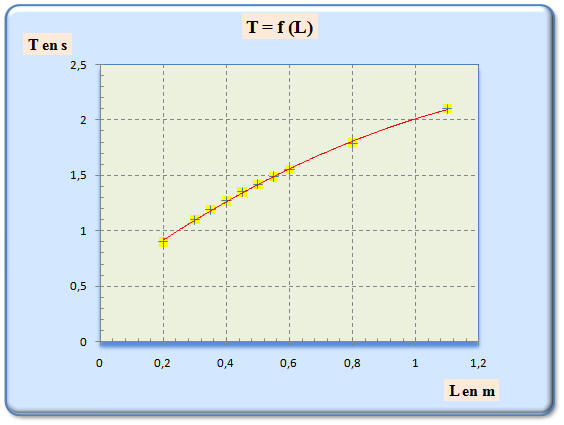
1)- Tracer la courbe représentant les variations de la période
T en
fonction de la longueur du pendule L.
- Tracé de la courbe
T =
f (L):
2)- La période T est-elle proportionnelle à la longueur
L du
pendule ? Justifier.
- Relation entre la période et la longueur du pendule :
- La période T n’est pas proportionnelle à la longueur L du pendule car la courbe obtenue n’est pas une droite passant par l’origine.
- Les points ne sont pas alignés.
3)- L’expérimentateur désire concevoir un pendule qui ‘’batte’’ la seconde, c’est-à-dire que le pendule change de sens exactement chaque seconde.
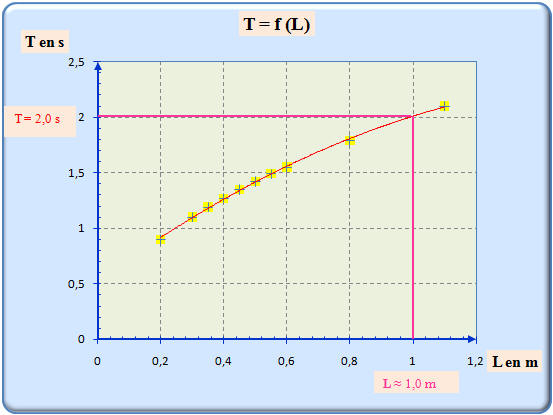
Utiliser la courbe précédente pour déterminer la longueur
L du
pendule. Justifier la réponse.
- Le pendule qui bat la seconde a une période
T = 2,0 s.
- Graphiquement, à l’aide de la courbe, on peut déterminer la valeur de la longueur du pendule associé,
- on trouve :
L ≈
4)- Finalement, le pendule fabriqué par l’expérimentateur retarde. Faut-il réduire ou augmenter la longueur L du pendule ?
Justifier la réponse.
- Raccourcir ou allonger un pendule qui retarde :
- Comme le pendule retarde, sa période T > 2,0 s.
- En conséquence, il faut raccourcir le pendule car la période du pendule
diminue lorsque la longueur du pendule diminue. |
III- Masse molaire, quantité de matière et volume.
|
Données : Masses molaires
atomiques : M (C)
=
M
(N) = 14,0 g / mol ;
M (S)
= Nombre d’AVOGADRO : NA = 6,02x 10 23 mol
– 1. |
|
1)- Dans le sang, on trouve différentes substances.
En particulier, on recherche lors d’une analyse de sang, le glucose (C6H12O6) et
l’urée (CH4N2O).
a)- Calculer la masse molaire de ces molécules.
- Masse molaire de la molécule de glucose :
- M
(C6H12O
6) =
- M
(C6H12O6)
≈
- Masse molaire de la molécule d’urée :
- M
(CH4N2O)
=
M (C) +
- M
(CH4N2O)
≈
b)- Calculer la quantité de matière contenue dans
m =
- Quantité de matière de glucose :
- n (C6H12O6) = m (C6H12O6) / M (C6H12O6)
- n (C6H12O6) = 1,00
/ 180
- n
(C6H12O6)
≈
5,56 x
10 – 3 mol
- Quantité de matière d’urée : - n (CH4N2O) = m (CH4N2O) / M (CH4N2O)
- n (CH4N2O) = 1,00
/
60,0
- n
(CH4N2O)
≈ 1,67
x 10 – 2
mol
c)- Calculer le nombre de molécules correspondant pour chaque substance.
- Nombre de molécules de glucose :
- N
(C6H12O6) =
n (C6H12O6)
.NA
- N
(C6H12O6) = 5,56
x 10 – 3
x
6,02 x 10 23
- N
(C6H12O6) ≈ 3,34
x 10 21
molécules
- Nombre de molécules d’urée :
- N
(CH4N2O)
= n (CH4N2O) . NA
- N
(CH4N2O)
= 1,67 x
10 – 2
x
6,02 x
10 23
- N
(CH4N2O)
≈
1,00 x
10 22 molécules 2)- L’éthanol est un liquide de formule (C2H6O) et de masse volumique
ρ
=
a)-
Calculer la masse molaire de l’éthanol.
- Masse molaire de l’éthanol :
- M
(C2H6O) =
- M
(C2H6O)
≈
b)- Calculer la quantité de matière n d’éthanol contenue dans un volume
V =
- Quantité de matière d’éthanol :
-
3)- La masse volumique de l’acide sulfurique (H2SO4) est
ρ
= Quel volume d’acide sulfurique liquide faut-il prélever pour obtenir 0,100 mol d’acide sulfurique ?
Décrire le mode opératoire pour prélever cette solution.
- Volume d’acide sulfurique nécessaire :
-
- Il faut utiliser les gants et les lunettes car le produit est corrosif.
- On verse la solution mère dans un bécher.
- On prélève 10 mL de la solution à l’aide d’une pipette graduée de 10 mL
munie de sa propipette.
- On en verse la quantité nécessaire, ici
V =
5,4 mL dans le récipient.
- On vide la pipette graduée dans le bécher et on la nettoie. |